Natriumchloriet (NaClo2) structuur, eigenschappen, gebruik, risico's

- 3075
- 510
- Ernesto McKenzie
Hij Natriumchloriet Het is een anorganische vaste stof gevormd door een ionen natrium na+ en een ion chloriet clo2-. De chemische formule is NaClo2. Het is een kristallijne witte vaste stof, naast een sterk oxidatiemiddel. Daarom moet het heel voorzichtig zijn.
Het belangrijkste gebruik is voor veel toepassingen als een desinfectiemiddel. Hiermee kunnen microben op oppervlakken zoals vloeren, muren en laboratoriumapparatuur in ziekenhuizen en klinieken en in hun watersystemen elimineren.
 Natriumchloriet NaClo2 stevig. Auteur: ChemicalInterest . Bron: Wikimedia Commons.
Natriumchloriet NaClo2 stevig. Auteur: ChemicalInterest . Bron: Wikimedia Commons. Ook in agrarische en veterinaire voorzieningen, om vogel -ei -incubators te hygiëniseren, om infecties van melkkoeien te regelen, om watersystemen voor dieren te desinfecteren, enz.
In de voedingsindustrie dienen hun aangezuurde waterige oplossingen om vlees, kippen, fruit, groenten, evenals de apparatuur van dergelijke faciliteiten te wassen.
Met natriumchloriet kan chloordioxide worden bereid2 Op de site van gebruik, waarmee u microben, slechte geuren en smaken van water kunt elimineren zodat het aangenaam is en zonder problemen kan drinken.
Het dient ook om papieren pulp, groentetextielvezels en oliën, naast andere toepassingen.
De NaClo2 vaste stof moet met voorzichtigheid worden afgehandeld, omdat in contact met bepaalde materialen explosies kunnen optreden. Hun oplossingen zijn iets gemakkelijker te manipuleren, maar ze zijn erg oxiderend en corrosief.
[TOC]
Structuur
Natriumchloriet bestaat uit een natrium na kation+ en een anion chloriet clo2- Daarom zijn ze verenigd door een ionische band.
Het chlorietanion heeft een chlooratoom in een +3 oxidatietoestand en twee zuurstofatomen met Valencia -2 elk. Om deze reden heeft het chlorietanion een negatieve last.
Het heeft ook een hoekvormige structuur.
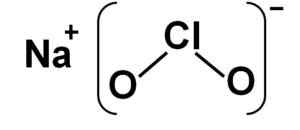 NACLO Natriumchlorietstructuur2. Auteur: Marilú Stea.
NACLO Natriumchlorietstructuur2. Auteur: Marilú Stea. Nomenclatuur
- Natriumchloriet
- Natriumchloriet
- Natriumzout van chloor
Eigenschappen
Fysieke staat
Kristallijne witte vaste stof.
Molecuulgewicht
90,44 g/mol.
Smeltpunt
Het ontleedt als het smelt tussen 180 en 200 ºC.
Dikte
2.468 g/cm3
Oplosbaarheid
Wateroplosbaar: 64 g/100 g water bij 17 ºC. Enigszins oplosbaar in methanol.
Andere eigenschappen
Het is enigszins hygroscopisch.
Het is een sterk oxidatiemiddel. Reageert gewelddadig met brandbare materialen en reductiemiddelen. Reageert heftig met zuren, waardoor chloordioxide clo wordt gegenereerd2.
Kan u van dienst zijn: Hume-rothery-regelsZijn alkalische oplossingen (het betekent in aanwezigheid van bijvoorbeeld NaOH) zijn vrij stabiel, terwijl in zuur medium de chloorzuur HCLO wordt gevormd2, die snel ontleedt:
4 HCLO2 → 2 clo2↑ + clo3- + Klet- + 2 H+ + H2OF
Risico's
Beide Naclo2 Solid omdat hun waterige oplossingen potentieel gevaarlijk zijn en veel voorzichtigheid en ervaring vereisen tijdens hun manipulatie en opslag.
De NaClo2 Solid kan ontploffen wanneer ze in contact komen met organische stoffen, waaronder handschoenen en kleding, morsen -controlematerialen zoals zaagsel en afval katoen, evenals oliën en vetten.
De vaste vorm is daarom erg moeilijk te transporteren en het heeft de voorkeur om het te gebruiken in de vorm van waterige oplossingen.
Deze oplossingen zijn extreem corrosief. Ze moeten bij voorkeur een pH boven 8 houden, dat wil zeggen een alkalische pH.
De NaClo2 versnelt de verbranding van verbindingen of brandbare materialen, tot het punt dat het hiermee explosieve mengsels kan vormen.
Indien verwarmd, stoot u giftige rook van HCl -zoutzuur en natriumoxide na2OF. Als het wordt verlengd, kan het exploiteren tot warmte of vuur.
Het verkrijgen van
Het wordt bereid beginnen met de chemische of elektrochemische reductie van Sodio NaClo3, In aanwezigheid van HCl -zoutzuur om chloordioxide -clo te produceren2.
De laatste reageert met waterstofperoxide H2OF2 In NaOH natriumhydroxide waterige oplossing en een natrium natriumchlorietoplossing wordt verkregen2, die de vaste stof verdampt en kristalliseert.
Het kan ook worden verkregen door het passeren van chloordioxidegas2 Voor een NaOH -oplossing.
2 clo2 + 2 NaOH → NaClo2 + Naclo3 + H2OF
Toepassingen
Als microbicide en desinfectiemiddel in meerdere toepassingen
Het is een ingrediënt van talloze producten die dienen om bacteriën, schimmels en slib of algen slib te beheersen. Producten die het voor dit doel bevatten, worden gebruikt in de landbouw, handel, industrie en woningen of huizen.
Het dient als een ontsmettingsmiddel van vele soorten materialen en oppervlakken.
In de landbouw zijn pluimvee en soortgelijke industrieën gedesinfecteerde harde oppervlakken, apparatuur, faciliteiten voor de incubatie van vogeleieren, kassen voor schimmels zoals champignons en koelwater en waterwatersystemen voor pennen met vogels.
Het heeft veterinair gebruik als een actueel ontsmettingsmiddel bij de controle van de mastitis van melkvee, om de tepels van het dier onder te dompelen. Mastitis is een infectie van koeien uders.
Kan u van dienst zijn: adiabatisch proces: typen, voorbeelden, opgeloste oefeningen Soms moet je koeien onderdompelen in natriumchlorietoplossingen om infecties erin te voorkomen. Auteur: Hans Braxmeier. Bron: Pixabay.
Soms moet je koeien onderdompelen in natriumchlorietoplossingen om infecties erin te voorkomen. Auteur: Hans Braxmeier. Bron: Pixabay. Het wordt ook gebruikt in natuurlijke onderzoeksinstellingen om laboratoria te ontsmetten.
Commercieel, industrieel en medisch gebruik omvat desinfecterende ventilatiesystemen, harde oppervlakken (zoals vloeren, muren, laboratoriumapparatuur) en watersystemen.
In zorginstellingen zoals klinieken en ziekenhuizen wordt het gebruikt om kamers, gangen, isolatiegebieden en materiaalsterilisatie te ontsmetten.
Het is ook handig voor het hygiëniseren in vestigingen waar mensen water- of spa -gezondheidsbehandelingen ondergaan.
In de voedingsindustrie wordt het gebruikt als een woest om voedsel te besparen.
Het wordt gebruikt in de vorm van zuur chloriet van verzuurde natrium. Dit wordt geproduceerd door het toevoegen van voedingskwaliteitzuur (bijvoorbeeld citroenzuur, fosforzuur, wielzuur of natriumzuursulfaat) aan een waterige oplossing van natriumchloriet.
Verzuurd natriumchloriet heeft antimicrobiële eigenschappen en wordt gebruikt als een dauw- of kippenwas- of wekenoplossing, vlees, groenten, fruit en zeeproducten. Ook in water om kip of vogels te bevriezen.
In huishoudens staat het toe om harde oppervlakken te desinfecteren, zoals vloeren en badkamers, verwarming of airconditioningsystemen en zwembadwatercirculatiesystemen.
 Om zwembaden te desinfecteren, kunt u natriumchloriet NaClo gebruiken2. Auteur: Age Global Group. Bron: Pixabay.
Om zwembaden te desinfecteren, kunt u natriumchloriet NaClo gebruiken2. Auteur: Age Global Group. Bron: Pixabay.  Producten die natriumchloriet bevatten, laten toiletbadkamers toe. Auteur: Michal Jarmoluk. Bron: Pixabay.
Producten die natriumchloriet bevatten, laten toiletbadkamers toe. Auteur: Michal Jarmoluk. Bron: Pixabay. Het wordt ook verkocht in kleine zakjes samen met andere verbindingen om gas en controlegeuren in huizen vrij te maken.
Om drinkwater te desinfecteren
Het wordt gebruikt bij de zuivering van water om te drinken, fungeert als een oxidatiemiddel, waardoor de smaak en geur van drinkwater worden verbeterd.
Natriumchloriet wordt veel gebruikt als een voorloper voor het genereren van Clo -chloordioxide2 die dient om drinkwater te behandelen voor menselijke consumptie, dat wil zeggen om micro -organismen, geuren en onaangename smaken te elimineren en kan drinken.
Om Clo te genereren2 HCl kan worden gebruikt:
5 NaClo2 + 4 HCl → 4 clo2↑ + 5 NaCl + 2 H2OF
De clo2 Het is een antimicrobieel middel van hoog actie oxidant en breed spectrum. Dat wil zeggen, handelt tegen een groot aantal micro -organismen.
Het kan u van dienst zijn: kaliumnitriet (kno2): structuur, eigenschappen en gebruikMicro -organismen worden gedeactiveerd omdat de clo2 interfereert met belangrijke enzymen hiervan en met celmembranen -eiwitten. Het heeft ook het voordeel dat het geen organochloorverbindingen produceert, die giftig zijn.
Er zijn te koop natriumchloriettabletten gemengd met andere verbindingen die in het water worden opgelost en onmiddellijk de clo produceren2 op een gecontroleerde manier, waardoor het water desinfecteert.
 Natriumchloriet wordt gebruikt met andere verbindingen om drinkwater klaar te maken om te drinken. Auteur: Ulrike Leone. Bron: Pixabay.
Natriumchloriet wordt gebruikt met andere verbindingen om drinkwater klaar te maken om te drinken. Auteur: Ulrike Leone. Bron: Pixabay. Het grootste probleem van het behandelen van water om smaken en geuren door clo te verwijderen2 Het bestaat in die toxische chloriet- en chloorzouten kunnen worden gevormd tijdens de behandeling.
Voor contactlenszorg
De NaClo2 Het is een onderdeel van de oplossingen die worden gebruikt om contactlenzen te desinfecteren.
Er wordt een NaClo -combinatie gebruikt2 en sporen (zeer kleine hoeveelheden) waterstofperoxide h2OF2.
De H2OF2 Stabiliseer de clo2 dat wordt gevormd en de combinatie van beide is zeer effectief tegen bacteriën, schimmels en gisten. De producten die dan zijn, zijn natriumchloride, water en zuurstof, die onschadelijk zijn, wat betekent dat ze niet schadelijk zijn voor het oog.
Wanneer de lenzen uit de oplossing worden verwijderd, NACLO2 Rest ontbindt snel in Nall en O2. Restperoxide irriteert het oog niet. Daarom zijn deze oplossingen zeer veilig.
 De oplossingen om contactlenzen te desinfecteren hebben natriumchloriet onder hun ingrediënten. Auteur: Nieuw ~ commonswiki. Bron: Wikimedia Commons.
De oplossingen om contactlenzen te desinfecteren hebben natriumchloriet onder hun ingrediënten. Auteur: Nieuw ~ commonswiki. Bron: Wikimedia Commons. In verschillende toepassingen
Natriumchloriet wordt gebruikt voor het bereiden van chloordioxide2 voor onmiddellijk gebruik in een groot aantal toepassingen waarvan sommige in eerdere paragrafen werden behandeld.
Het dient om houten pulp, textiel zoals katoen, plantenvezels, eetbare en niet -edelbare oliën, vetten, vernis, lakken en wassen te bleken.
Het is een onderdeel van oogdruppels en enkele oplossingen voor mondelinge wassen.
Het wordt gebruikt in de lederen verwerkingsindustrie en in agenten voor metaalelektrode (metaalcoating).
Referenties
- Williams, l. et al. (2019). Microbiologie, lenszorg en onderhoud. In contactlenzen (zesde editie). Hersteld van Scientedirect.com.
- OF.S. Nationale bibliotheek van geneeskunde. (2019). Natriumchloriet. Hersteld van PubChem.NCBI.NLM.NIH.Gov.
- Grijs, n.F. (2014). Chloordioxide. Procestechnologie. In microbiologie van waterziekten (tweede editie). Hersteld van Scientedirect.com.
- McKen, L. (2012). Inleiding tot FoodRadition en Medical Sterilization. Chloordioxide. In het effect van sterilisatie op plastic en elastomeren (derde editie). Hersteld van Scientedirect.com.
- Ortenberg, E. en Telsch, B. (2003). Smaak- en geurproblemen in drinkwater. In Handbook of Water and Dastewater Microbiology. Hersteld van Scientedirect.com.
- Karsa, D.R. (2007). Biociden. Chloordioxide. In handboek voor het reinigen/ontsmetten van oppervlakken. Hersteld van Scientedirect.com.
- Katoen, f. Albert en Wilkinson, Geoffrey. (1980). Geavanceerde anorganische chemie. Vierde druk. John Wiley & Sons.
- Ullmann's Encyclopedia of Industrial Chemistry. (1990). VIJFDE EDITIE. VCH VerlagSgellschaft MBH.

