Cytosinestructuur, functies, eigenschappen, synthese
- 2383
- 139
- Kurt Aufderhar Jr.
De Cytosine Het is een pyrimidinestikstofbasis, die dient voor de biosynthese van cytidine-5'-monofosfaat en dexicitidine-5'-monofosfaat. Deze verbindingen dienen voor biosynthese, respectievelijk, van deoxyribonucleïnezuur (DNA) en ribonucleïnezuur (RNA). DNA slaat genetische informatie op en RNA heeft verschillende functies.
In levende wezens wordt cytosine niet vrij gevonden, maar vaak ribonucleotiden of deoxyribonucleotiden. Beide soorten verbinding hebben een fosfaatgroep, een ribose en een stikstofbasis.
 Bron: vesprom [Public Domain]
Bron: vesprom [Public Domain] De koolstof 2 van de ribose heeft een oxhydrillo (-oH) groep in de ribonucleotiden en een waterstofatoom (-H) in de deoxyribonucleotiden. Afhankelijk van het aantal aanwezige fosfaatgroepen is er Citidín-5'-monofosfaat (CMP), Citidín-5'-difosfaat (CDP) en Citidín-5'-triffosfaat (CTP) (CTP) (CTP).
Desoxygenated equivalenten worden desoxicitidine-5'-monofosfaat (DCMP), desoxicitidine-5'-difosfaat (DCDP) en desoxicitidine-5'-triffosfaat (DCTP) genoemd (DCTP), desoxicitidine-5'-difosfo.
Cytosine neemt in zijn verschillende vormen deel aan verschillende functies, zoals de biosynthese van DNA en RNA, de biosynthese van glycoproteïnen en de regulatie van de expressie van het gen.
[TOC]
Structuur en eigenschappen
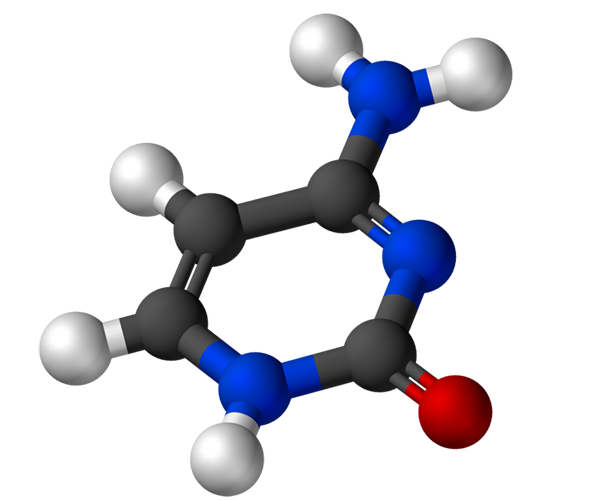
De cytosine, 4-amino-2-hydroxipirimidine, heeft de empirische formule c4H5N3Of waarvan het molecuulgewicht 111,10 g/mol is en wordt gezuiverd als een wit poeder.
De structuur van de cytosine is een heterocyclische, aromatische en vlakke ring. De maximale absorptiegolflengte (ʎMaximaal) Het is 260 nm. De fusietemperatuur van het cytosine overschrijdt 300 ºC.
Om een nucleotide te vormen, bindt cytosine covalent, door stikstof 1, door middelen. Koolstof 5 'wordt versterkend met een fosfaatgroep.
Biosynthese
Pyrimidine -nucleotide -biosynthese heeft een gemeenschappelijke route, die bestaat uit zes stappen gekatalyseerd door enzymen. De weg begint met carbamoil-fosfaatbiosynthese. In prokaryoten is er slechts één enzym: carbamoilfosfaatsynthase. Dit is verantwoordelijk voor de synthese van pyrimidines en glutamine. In eukaryoten zijn er carbamoilfosfaatsynthase I en II, die respectievelijk verantwoordelijk zijn voor glutamine- en pyrimidinebiosynthese.
De tweede stap bestaat uit de vorming van N-carbamoilaspartato, uit carboilfosfaat en aspartaat, reactie gekatalyseerd door de transpartaat transcabamoilasa (Atcasa).
De derde stap is de synthese van l-dihydrotoaat, die de sluiting van de pyrimidinring produceert. Deze stap wordt gekatalyseerd door dihydrootase.
De vierde stap is de vorming van orotato, een redoxreactie gekatalyseerd door dihydroorotaatdehydrogenase.
De vijfde stap bestaat uit de vorming van goldylaat (omp) met behulp van fosforibosylpyrofosfaat (PRPP) als een substraat, en de fosforibosyl orotaattransferase als katalysator als katalysator.
De zesde stap is de vorming van uridilaïto (uridine-5'-monofosfaat, ump), reactie gekatalyseerd door een omp-decarboxylase.
Het kan je van dienst zijn: flora en fauna van HidalgoDe volgende stappen bestaan uit de fosforylering van de ump, gekatalyseerd door kinasen, om UTP te vormen, en de overdracht van een aminogroep van glutamine naar de UTP om CTP te vormen, reactie gekatalyseerd door CTP -synthetase.
Biosynthese -regulering
Bij zoogdieren vindt regulering plaats bij de carbamoilfosfaatsynthase.
Carbamoil Syntasa II wordt gereguleerd door negatieve feedback. De toezichthouders, de UTP en de PRPP, zijn respectievelijk remmer en activator van dit enzym.
In weefsels die niet hepatisch zijn, is carbamoilfosfaatsynthase II de enige bron van carbamoilfosfaat. Terwijl in de lever, onder omstandigheden van overtollige ammoniak, produceert carbamoilfosfaatsynthase I, in de mitochondriën, carbamoilfosfaat, dat naar het cytosol wordt getransporteerd, vanwaar het het pad van biosynthese van pyrimidines binnenkomt.
Een ander regulatiepunt is OMP-Discarboxylase, dat wordt gereguleerd door competitieve remming. Het product van zijn reactie, UMP, concurreert met de OMP voor de bindingsplaats in de omp-descarboxilasa.
Pyrimidines, zoals cytosine, worden gerecycled
Het recyclen van pyrimidines heeft als functie het hergebruik van pyrimidines zonder de noodzaak van novo -biosynthese en vermijdt het afbraakpad. De recyclingreactie wordt gekatalyseerd door fosforibosyltransferase pyrimimidine. De algemene reactie is als volgt:
Pyrimidine + PRPP -> nucleoside pyrimidine 5 '-monofosfaat + PPI
In gewervelde dieren wordt fosforibosyltransferase pyrimimidine gevonden in erytrocyten. Het pyrimidines -substraat van dit enzym zijn uracil, timina en orotato. Cytosine wordt indirect gerecycled uit uridine-5'-monofosfaat.
Functie in DNA -biosynthese
Tijdens DNA -replicatie wordt de informatie in het DNA in het DNA gekopieerd via een DNA -polymerase.
RNA -biosynthese heeft deoxynucleotiden -tryposfaat (DNTP) nodig, namelijk: dexitimid tryphosfaat (DTTP), dexicitidy triffosfaat (DCTP), de -alxyxyadenin tryphysse (datp) en Dexiguanin tryfosfaat (DGTP) (DGTP). De reactie is:
(DNA)n afval + DNTP -> (DNA)N+1 Afval + PPI
Anorganisch pyrofosfaat (PPI) hydrolyse levert energie voor de biosynthese van RNA.
Functie bij de stabilisatie van de structuur van DNA
In de dubbele DNUS -helix is een purine, van een ketting, gekoppeld aan pyrimidine, van de tegenovergestelde keten, door waterstofbruggen. Aldus is cytosine altijd gekoppeld aan guanine door drie waterstofbruggen: adenine is gekoppeld aan timin door twee waterstofbruggen.
Het kan u van dienst zijn: het belang van biologieWaterstofbindingen worden verbroken wanneer een gezuiverde natieve DNA -oplossing bij pH 7, wordt onderworpen aan temperaturen van meer dan 80 ºC. Dit zorgt ervoor dat de dubbele DNA -propeller twee afzonderlijke ketens vormt. Dit proces staat bekend als denaturatie.
De temperatuur waarbij 50% van het DNA wordt gedenatureerd, staat bekend als de smelttemperatuur (TM). DNA -moleculen waarvan de guanine en cytosine.
Het bovenstaande is de experimentele test dat een groter aantal waterstofbruggen de natieve DNA -moleculen beter stabiliseert.
Functie van rijke gebieden in cytosine in DNA
Onlangs werd vastgesteld dat het DNA van de menselijke celkern geïntercaleerde motiefstructuren kan overnemen (IM). Deze structuren worden geproduceerd in cytosinegebieden.
De IM -structuur bestaat uit vier DNA -ketens, in tegenstelling tot het klassieke dubbele propeller -DNA dat twee ketens heeft. Meer specifiek worden twee parallelle duplexketens afgewisseld in een antiparallela -oriëntatie en worden ze samen bewaard door een paar hemiprotoned cytosines (C: C: C: C+)).
In het menselijke genoom worden IM -structuren gevonden in regio's zoals promotors en telomeren. Het aantal IM -structuren is hoger tijdens de G1/S -fase van de celcyclus, waarin de transcriptie hoog is. Deze regio's zijn eiwitherkenningsplaatsen die betrokken zijn bij de activering van transcriptionele machines.
Aan de andere kant, in de regio's die rijk zijn aan guaninebases (c) opeenvolgende, neigt DNA de neiging om de propeller vorm A aan te nemen, in uitdrogingsvoorwaarden. Deze vorm is typerend voor RNA en dubbele DNA-ARR-gemengde banden tijdens transcriptie en replicatie, en op bepaalde momenten wanneer DNA is gekoppeld aan eiwit.
Er is aangetoond dat de regio's met opeenvolgende cytosinebases een elektropositieve patch creëren in de hoofdgreep van het DNA. Daarom wordt aangenomen dat deze gebieden binden aan eiwitten, die bepaalde genomische gebieden van genetische fragiliteit vatbaar maken.
Functie in RNA -biosynthese
Tijdens transcript wordt de informatie in het DNA in het RNA gekopieerd via een PON -polymerase RNA. RNA -biosynthese heeft tryposfaatnucleosiden (NTP) nodig, namelijk: tryphyscitidine (CTP), tryposfaat uridine (UTP), adenine tryposfaat (ATP) en tryphosfaatguanine (GTP). De reactie is:
Kan u van dienst zijn: Flora en Fauna of Campeche: Representative Soorten(RNA)n afval + NTP -> (RNA)N+1 Afval + PPI
Anorganisch pyrofosfaat (PPI) hydrolyse levert energie voor de biosynthese van RNA.
Functie in biosynthese van glycoproteïnen
De opeenvolgende overdracht van hexosen om de oligosachariden te vormen, O-Ligates naar eiwitten, gebeurt van nucleotide-voorlopers.
In gewervelde dieren bestaat de laatste stap van de biosynthese van O-geligeerde oligosacchariden uit de toevoeging van twee sinaal zuurafval (N-acetylneuramine) uit een voorloper van citidine-5'-monofosfaat (CMP). Deze reactie wordt geproduceerd in de transzack van Golgi.
Cytosine- en chemotherapiebehandelingen tegen kanker
Tetrahydropholaatzuur (FH4) is een groep -chbron3, En het is noodzakelijk voor DTMP -biosynthese van dump. FH2 wordt ook gevormd. FH2 -reductie tot FH4 vereist een foliumzuur- en NADPH -reductase. Sommige foliumzuurreductaseremmers, zoals aminopterine en metretothrexaat, worden gebruikt bij kankerbehandelingen.
Metotrexan is een competitieve remmer. De foliumzuurreductase sluit zich aan bij 100 keer meer affiniteit met deze remmer dan met zijn substraat. Aminapterijn werkt op dezelfde manier.
De remming van foliumzuurreductase belemmert indirect DTMP -biosynthese, en dus die van DCTP. Directe remming vindt plaats door de remmers van het timidilaatsynthetase, dat DTMP katalyseert van dump. Deze remmers zijn 5-fluorouracil en de 5-fluoro-2-dioxiuridine.
5-fluoroacil is bijvoorbeeld geen remmer, maar wordt eerst de recyclingroute in deoxyuride mofosfaat D (FDUMP), die bindt aan het timidilaatsynthesase en remt.
Stoffen analoog aan glutamine, azaserine en acivicine, remmen amidotransferase glutamine. Azarine was een van de eerste ontdekte stoffen die fungeren als suïcidaal inactiveren.
Referenties
- Assi, h.NAAR., Garav's, m., González, c., En damha, m.J. 2018. I-MOTIF DNA: structurele kenmerken en betekenis voor celbiologie. Kernenzurenonderzoek, 46: 8038-8056.
- Bohinski, r. 1991. Biochemie. Addison-Wesley IberoAmericana, Wilmington, Delaware.
- Devlin, T.M. 20000000000000000000. Biochemie. Redactionele terugvordering, Barcelona.
- Lodish, h., Berk, een., Zipurski, s.L., Matsudaria, p., Baltimore, D., Darnell, J. 2003. Cellulaire en moleculaire biologie. Redactionele medica Panamericana, Buenos Aires, Bogotá, Caracas, Madrid, Mexico, Sāo Paulo.
- Nelson, D. L., Cox, m. M. 2008. Lehninger-Principles of Biochemistry. W.H. Freeman, New York.
- VOET, D. en Voet, j. 2004. Biochemie. John Wiley and Sons, VS.

