Cyclooxygenasetypen, reactie, remmers
- 1812
- 147
- Glen Armstrong
De cyclooxygenasen (Coxs), ook bekend als prostaglandine H -synthase of prostaglandine -endoperoxidesyntheses, zijn oxygenase vetzuur enzymen die behoren tot myeloperoxidase -superfamilie en gevonden in alle gewervelde dieren.
Cycoxygenasen zijn bifunctionele enzymen, omdat ze twee verschillende katalytische activiteiten hebben: de ene cyclooxygenase -activiteit en een andere peroxidase, waardoor ze de kunnen katalyseren Bis-Oxygenatie en reductie van arachidonzuur om prostaglandine te vormen.
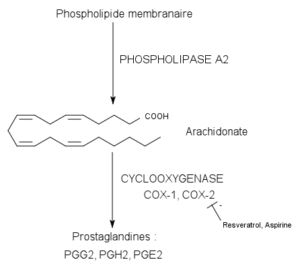 Gekataliseerde reactie door cycloxygenase-enzymen (Bron: Pancrat [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)] via Wikimedia Commons)
Gekataliseerde reactie door cycloxygenase-enzymen (Bron: Pancrat [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)] via Wikimedia Commons) Ze zijn niet gevonden in planten, insecten of in eencellige organismen, maar in gewervelde cellen deze enzym, blaasjes, enz.
De eerste detecties van de producten gesynthetiseerd door de cyclooxygenasen werden gemaakt in zaadvloeistoffen, dus werd aanvankelijk gedacht dat het stoffen waren die in de prostaat waren geproduceerd, daarom werden ze "prostaglandins" genoemd.
Tegenwoordig is het bekend dat prostaglandinen worden gesynthetiseerd in alle weefsels van gewervelde dieren en zelfs in organismen die geen prostaatklieren hebben, en dat de verschillende isomeren van deze moleculen verschillende functies hebben in verschillende fysiologische en pathologische processen zoals koorts, gevoeligheid voor het Gevoeligheid voor pijn of algees, ontsteking, trombose, mythogenese, vasodilatie en vasoconstrictie, ovulatie. nierfunctie, etc.
[TOC]
Jongens
Het bestaan van twee soorten cyclooxygenasen tussen gewervelde dieren is gemeld. De eerste die wordt ontdekt en gezuiverd, staat bekend als COX-1 of gewoon Cox, en werd voor het eerst gezuiverd in 1976 vanuit de zaadblaasjes van schapen en koeien.
De tweede cycloxigenase ontdekt onder de eukaryoten was COX-2, in 1991. Tot op heden is bewezen dat alle gewervelde dieren, inclusief kraakbeenvissen, botvissen, vogels en zoogdieren, twee genen hebben die coderen voor COX -enzymen.
Het kan u van dienst zijn: Fungi -circulatie: voedingsstoffen, stoffen, osmoregulatieEen van hen, COX-1, Codeert voor cyclooxigenase 1, die constitutief is, terwijl het gen COX-2 Codeert voor induceerbare cyclooxygenase.
Kenmerken van beide genen en hun enzymatische producten
COX-1 en COX-2-enzymen zijn vrij gelijkaardig, wat wordt opgevat als 60-65% gelijkenis tussen zijn aminozuursequenties.
De genen COX-1 Orthologen (genen in verschillende soorten die dezelfde oorsprong hebben) in alle soorten gewervelde dieren produceren COX-1-eiwitten die tot 95% van de identiteit van hun aminozuursequenties delen, wat ook waar is voor de orthologen van COX-2, wiens producten aan het aandeel zijn tussen 70 en 90% identiteit.
Cnidariërs en ascidieën hebben ook twee genen Cox, Maar deze verschillen van die van andere dieren, dus sommige auteurs veronderstellen dat deze genen zouden kunnen zijn ontstaan in onafhankelijke duplicatie -gebeurtenissen van dezelfde gemeenschappelijke voorouder.
COX-1
De generatie Cox-1 weegt ongeveer 22 kb en wordt constitutief tot expressie gebracht om te coderen.
Dit eiwit bevindt zich voornamelijk in het endoplasmatische reticulum en de algemene structuur is in de vorm van een homodimeer, dat wil zeggen twee identieke polypeptideketens die geassocieerd zijn met het vormen van het actieve eiwit.
COX-2
De generatie Cox-2 daarentegen weegt ongeveer 8 kb en de expressie ervan wordt geïnduceerd door cytokines, groeifactoren en andere stoffen. Dit codeert voor het COX-2-enzym dat het heeft, inclusief het signaalpeptide, 604 aminozuurafval en 581 na de verwerking.
Kan u van dienst zijn: anaërobe ademhalingDit enzym is ook homodimeer en zit tussen het endoplasmatische reticulum en het nucleaire gewikkelde.
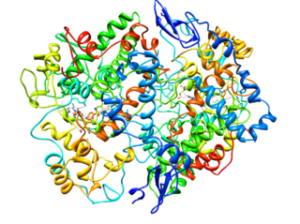 Moleculaire structuur van het type 2 cycloxygenase (COX-2) (Bron: Cytochrome C bij Engelse Wikipedia [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)] via Wikimedia Commons)
Moleculaire structuur van het type 2 cycloxygenase (COX-2) (Bron: Cytochrome C bij Engelse Wikipedia [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)] via Wikimedia Commons) Uit de analyse van hun structuren is vastgesteld dat COX-1 en COX-2 enzym Engels Epidermale groeifactor)).
In deze module zijn extreem bewaarde disulfidebindingen of bruggen, die functioneren als "dimerisatiedomein" tussen de twee polypeptiden van elk homodimeer enzym.
Eiwitten hebben ook amfipatische propellers die verankering vergemakkelijken naar een van de membraanlagen. Bovendien heeft het katalytische domein van beide twee actieve plaatsen, een met cyclooxygenase -activiteit en een andere met peroxidase -activiteit.
Beide enzymen zijn extreem bewaarde eiwitten, die tot verschillende soorten weinig significante verschillen zijn met betrekking tot de mechanismen van dimerisatie en unie naar het membraan, evenals enkele kenmerken van hun katalytische domeinen.
Cox -eiwitten hebben bovendien glycosyleringsplaatsen die essentieel zijn voor hun werking en die absoluut bewaard zijn.
Reactie
Cycloxygenase-enzymen 1 en 2 zijn verantwoordelijk voor het katalyseren van de eerste twee stappen van de biosynthese van prostaglandine, die beginnen met de omzetting van arachidonzuur in voorlopers van prostaglandines bekend als hydroperoxi-endoperoxide PGG2.
Om deze enzymen hun functies uit te oefenen, moeten ze eerst worden geactiveerd via een proces dat afhankelijk is van hun peroxidase -activiteit. Met andere woorden, de hoofdactiviteit ervan hangt af van de reductie van een peroxidesubstraat (gemedieerd door de actieve peroxidase -plaats) zodat de oxidatie van het ijzer geassocieerd met de hemobroep die als een cofactor dient, optreedt.
Het kan u van dienst zijn: Monera Kingdom: Kenmerken, classificatie en voorbeeldenDe oxidatie van de hemo -groep veroorzaakt de vorming van een tyrosil -radicaal in het actieve plaatscycloxygenase, dat het enzym activeert en de initiatie van de cyclooxygenase -reactie bevordert. Deze activeringsreactie kan slechts eenmaal optreden, omdat het tyrosil -radicaal wordt geregenereerd tijdens de laatste reactie van de route.
Remmers
Cyclooxygenasen zijn betrokken bij de synthese van prostaglandines, die hormonen zijn met functies in de bescherming van het darmslijmvlies, bij de aggregatie van bloedplaatjes en bij de regulatie van de nierfunctie, naast deelname aan de processen van ontsteking, pijn en pijn en koorts.
Gezien het feit dat deze enzymen de sleutel zijn tot de productie van deze hormonen, vooral die die te maken hebben met ontstekingsprocessen, hebben talloze farmacologische studies zich gericht op de remming van cyclooxygenasen.
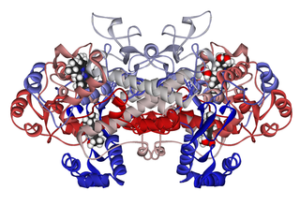 Moleculaire structuur van cycloxigenase 1 gekoppeld aan ibuprofen (Bron: FvasConcellos 5 mei 2007 [Public Domain] via Wikimedia Commons)
Moleculaire structuur van cycloxigenase 1 gekoppeld aan ibuprofen (Bron: FvasConcellos 5 mei 2007 [Public Domain] via Wikimedia Commons) Aldus is aangetoond dat het werkingsmechanisme van veel niet-steroïde ontstekingsremmende geneesmiddelen te maken heeft met onomkeerbare of omkeerbare (remmende) acetylering van de actieve locatie cyclooxigenase in deze enzymen.
Onder deze medicijnen zijn piroxicam, ibuprofen, aspirine, flurbiprofen, diclofenac, naproxen en anderen.
Referenties
- Botting, r. M. (2006). Remmers van cyclooxygenasen: mechanismen, selectiviteit en gebruik. Journal of Physiology and Pharmacology, 57, 113.
- Chandrasekharan, n. V., & Simmons, D. L. (2004). De cyclooxygenasen. Genome Biology, 5 (9), 241.
- Fitzpatrick, f. NAAR. (2004). Cyclooxygenase -enzymen: regulatie en functie. Huidig farmaceutisch ontwerp, 10 (6), 577-588.
- Kundu, n., Smyth, m. J., Samsel, L., & Fulton, aan. M. (2002). Cyclooxygenaseremmers blokkeren de celgroei, verhoogt ceramide en remmen de celcyclus. Onderzoek en behandeling van borstkanker, 76 (1), 57-64.
- Rauzer, c. NAAR., & Marnett, L. J. (2009). Cyclooxygenasen: structurele en functionele inzichten. Journal of Lipid Research, 50 (supplement), S29-S34.
- Vane, J. R., Bakhle, en. S., & Botting, r. M. (1998). Cyclooxygenzen 1 en 2. Jaaroverzicht van farmacologie en toxicologie, 38 (1), 97-120.
- « Overwater oorzaken, effecten en oplossingen
- De 101 beste micro -storingen voor jongeren en volwassenen »

