Cadherinas structuur, kenmerken en functies
- 3562
- 1021
- Miss Herman Russel
De Cadherinas Het zijn transmembranale glycoproteïnen die afhankelijk zijn van calcium en verantwoordelijk voor het handhaven van de unie tussen cellen die het mogelijk maken de integriteit van weefsels in dieren te behouden. Er zijn meer dan 20 verschillende soorten cadherines, allemaal met ongeveer 750 aminozuren, en die zijn gespecificeerd uit verschillende soorten cellen.
De celbonden die door de cadherine zijn bereikt, zijn in de loop van de tijd stabiel. Daarom spelen deze moleculen een belangrijke rol bij de ontwikkeling van de vorm van het lichaam tijdens de embryonale ontwikkeling (morfogenese), evenals bij het behoud van de structuur van weefsels, zowel in het embryonale stadium als in het volwassen leven.
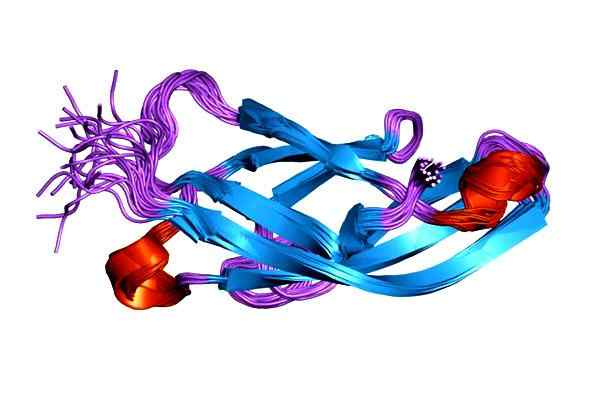
 Moleculaire weergave van het 1SUH-eiwit, e-cadherina (epitheliaal). Genomen en bewerkt uit: Jawahar Swaminathan en MSD -personeel van het European Bioinformatics Institute [Public Domain].
Moleculaire weergave van het 1SUH-eiwit, e-cadherina (epitheliaal). Genomen en bewerkt uit: Jawahar Swaminathan en MSD -personeel van het European Bioinformatics Institute [Public Domain]. De storing van de cadherine wordt geassocieerd met de ontwikkeling van verschillende soorten kanker. Het tekort aan celadhesie door cadherine is een van de oorzaken van de toename van de motiliteit van tumorcellen.
[TOC]
Cellulaire adhesiemoleculen
In meercellige organismen moeten cellen meedoen om deel te nemen aan grote diversiteit aan biologische processen die het mogelijk maken hun integriteit te behouden, waardoor koloniale eencellige organismen worden onderscheiden. Deze processen omvatten onder andere hemostase, immuunrespons, morfogenese en differentiatie.
Deze moleculen verschillen in hun structuur, evenals in hun functie, in vier groepen: integrines, selectinas, immunoglobulines en cadherines.
Geschiedenis
De geschiedenis van de cadherine is erg kort, omdat ze elkaar heel recent hebben gekend. Aldus werd de eerste cadherina ontdekt in cellen van muizenweefsels, in 1977. Wetenschappers noemden dit uvomorulinemolecuul.
In de jaren tachtig werd de ontdekking van vele andere cadherinemoleculen in weefsels van verschillende soorten bereikt. Deze cadherines werden gevonden in calciumafhankelijke tests van celaggregaties. Ze behoorden allemaal tot dezelfde groep moleculen die klassieke cadherines worden genoemd.
Kan u van dienst zijn: cellysisIn de afgelopen jaren, en dankzij de vooruitgang in de moleculaire biologie, zijn wetenschappers erin geslaagd om een ander belangrijk aantal cadherinas te identificeren, van sommige waarvan hun specifieke functie onbekend is, en dat zou andere functies kunnen hebben dan cellulaire adhesie.
Structuur
Cadherines zijn glycoproteïnen, dat wil zeggen moleculen gevormd door associatie van een eiwit en een koolhydraat. Ze worden gevormd door tussen de 700 (in het algemeen 750) en 900 aminozuren, en hebben verschillende functionele domeinen, waardoor het eerst kan interageren met andere cadherinemoleculen en met calciumionen.
Functionele domeinen staan ook cadherine toe. Het grootste deel van de aminozuurketen bevindt zich in het extracellulaire gebied en verschilt normaal in vijf domeinen, EC (EC1 - EC5) genoemd.
Elk van deze domeinen heeft ongeveer 100 aminozuren, met een of twee calciumbondsplaatsen. Het transmembranale gebied bevindt zich tussen de buitenkant en het interne deel van de cel en kruist het membraan eenmaal.
Aan de andere kant is het deel van de cadherines in de cel zeer conservatief en bestaat uit 150 aminozuren. Dit domein bindt aan actine cytoskelet door middel van cytosolische eiwitten die Catenins worden genoemd.
Jongens
Er zijn meer dan 20 verschillende soorten cadherines, die op verschillende manieren worden geclassificeerd, afhankelijk van de auteurs. Dus bijvoorbeeld, sommige auteurs herkennen twee groepen of subfamilies, terwijl anderen zes herkennen. Volgens de eerste kunnen cadherines worden verdeeld in:
Klassieke cadherines of type i
Ook wel traditionele cadherines genoemd. In deze groep werden de cadherines die volgens de stof werden genoemd waar ze voor het eerst werden gevonden, zoals e-cadherina (epitheliaal), de N-cadherine (neuraal), de p-cadherine (placenta), de l- Cadherina (placenta) zijn opgenomen in deze groep (placenta), de L-Cadherina (lever) en R-Cadherina (Retina). Deze glycoproteïnen zijn echter te vinden in verschillende weefsels.
Kan u van dienst zijn: mesosoomN-cadherina kan bijvoorbeeld, naast het aanwezig zijn in het neurale weefsel, zich ook bevinden in weefsels van de testikels, nier-, lever- en cardiale musculatuur.
Atypische cadherinas of type II
Ook wel niet -traditioneel of niet -klassiek genoemd. Ze omvatten demagetten en democolines, die vakbonden vormen op het niveau van intercellulaire desmosomen. Er zijn ook de protocadherines, gekenmerkt door gebrek aan verbindingen met het actinia -cytoskelet.
Al deze cadherina zijn gescheiden van andere niet -traditionele, door sommige auteurs, in drie onafhankelijke groepen. De rest van de atypische cadherines omvat de T-cadherina, die geen transmembraan en cytoplasmatische domeinen en een variant van de e-cadherine, die buiten de cel bevindt en dat Evar-Cadherina wordt genoemd, ontbreekt en dat Evar-Cadherina wordt genoemd.
Kenmerken
Het zijn calciumafhankelijke glycoproteïnen die bijna uitsluitend in dierenweefsels zijn. De meeste van hen zijn transmembrales van een enkele stap; dat wil zeggen dat ze aanwezig zijn in het celmembraan, en het bij een gelegenheid van links naar rechts kruipen.
Cadherines nemen voornamelijk deel aan de vereniging tussen cellen met semi -gebonden fenotypische kenmerken (homotypische of homofiele links). Cellulaire gewrichten bereikt door deze moleculen (cadherine-cadherine-bindingen) zijn ongeveer 200 keer sterker dan andere eiwit-eiwitbonden.
In traditionele cadherine is het cytoplasmatische domein zeer conservatief. Dit betekent dat de samenstelling vergelijkbaar is in de verschillende cadherine.
Functie
De belangrijkste functie van cadherine is om permanente cellulaire vakbonden in de loop van de tijd toe te staan, dus spelen ze een fundamentele rol in processen zoals embryonale ontwikkeling, morfogenese, differentiatie en structureel onderhoud van epitheliale weefsels in de huid en darm, evenals axonsvorming, evenals axonsvorming,.
Deze functie wordt gedeeltelijk gereguleerd door de terminal -cooh aanwezig in het intracellulaire domein van glycoproteïne. Deze terminal interageert met moleculen genaamd Catenins, die op hun beurt interageren met de elementen van het celcytoskelet.
Kan u van dienst zijn: polymorfonucleaire leukocytenAndere functies van de cadherines omvatten selectiviteit (ervoor kiezen om die een andere celeenheid) en celsignalering, het vaststellen van celpolariteit en apoptose -regulatie. Dit laatste is intern een mechanisme van celdood intern door hetzelfde lichaam om de ontwikkeling ervan te reguleren.
Cadherines en kanker
Cadherinas -storing is betrokken bij de ontwikkeling van verschillende soorten kanker. Deze storing kan te wijten zijn aan modificaties in de expressie van cadherines en catenins, evenals de activering van signalen die de vereniging van cellen voorkomen.
Wanneer de cellulaire vereniging van de cadherines mislukt, kan tumorcellen hun motiliteit verhogen en worden vrijgegeven, en vervolgens aangrenzende weefsels binnendringen door lymfatische knobbeltjes en bloedvaten.
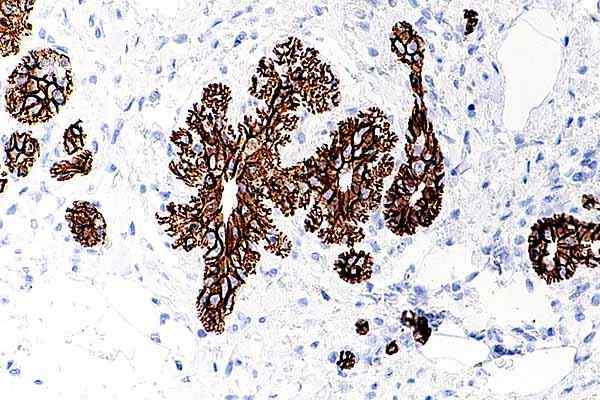 E-Cadherina Benigma de Mama. Microfoto van atypische lobulaire hyperplasie. Genomen en bewerkt uit: Nephron [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)].
E-Cadherina Benigma de Mama. Microfoto van atypische lobulaire hyperplasie. Genomen en bewerkt uit: Nephron [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)]. Wanneer deze cellen de witte organen bereiken, vallen ze binnen en prolifereren ze, waardoor invasieve en metastatische karakters worden verkregen. De meeste werken die cadherine hebben gekoppeld aan carcinogene groeiprocessen, zijn gericht op e-cadherine.
Dit type cadherina is betrokken bij darmkanker, maag, borst, eierstokken en long, onder andere. Dit is echter niet de enige cadherina die verband houdt met kanker. De N-Cadherina speelt bijvoorbeeld een rol in pleurale en rabdomiosarcomen mesoteliomen.
Referenties
- Cadherin. In Wikipedia. Opgehaald van.Wikipedia.borg
- D. Leckband & a. Prakasam (2006). Mechanisme en dynamische cadherine -hechting. Jaaroverzicht van Biomedical Engineering.
- F. Nolletl, p. Kools P, & F. Van Roy (2000). Fylogenetische analyse van de cadherine -superfamilie maakt identificatie mogelijk van zes grote subfamilies naast verschillende solitaire leden. Journal of Molecular Biology.
- J. Günther & E. PEDERNERA-GASTAGIAN (2011). E-Cadherina: sleutelstuk in neoplastische transformatie. Klinisch bewijs en onderzoeksmagazine.
- L. Petruzzelli, m. Takami & D. Humes (1999). Structuur en functie van celadhesiemoleculen. American Journal of Medicine.
- OF. Cavallaro & G. Christofori (2004). Celadhesie en signalering door cadherines en Ig-cam s bij kanker. Nature reviews kanker.

