Natriumbromide (NABR)
- 3808
- 420
- Glen Armstrong
Wat is natriumbromide?
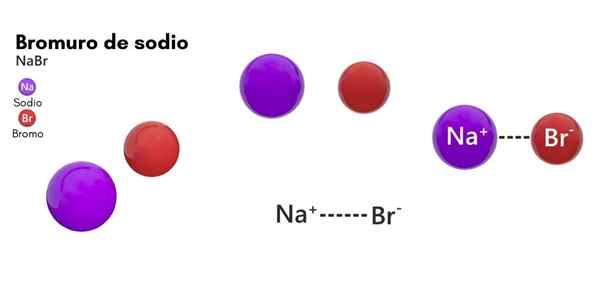
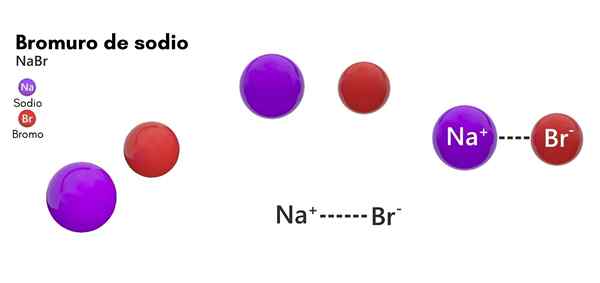
Hij natriumbromide Het is een chemische soort die behoort tot de zouten van anorganische oorsprong. De structuur bestaat uit het bromische halogeen en het natriummetallische element in 1: 1. De chemische formule is Nabab en bevindt zich in een toestand van vaste aggregatie in standaardtemperatuuromstandigheden (25 ° C en 1 atm).
Normaal gesproken kan het worden waargenomen als een wit stof en wordt het beschouwd als een verbinding met kristallijn type dat ook een hygroscopisch gedrag manifesteert; dat wil zeggen, het heeft de mogelijkheid om vocht uit zijn omgeving te absorberen.
Evenzo heeft natriumbromide fysieke kenmerken die zeer vergelijkbaar zijn met een andere ionische verbinding van hetzelfde metaal: natriumchloride. Dit chloride wordt weergegeven als NaCl, dat vaker bekend staat als gewone zout- of tafelzout.
Het heeft een groot aantal toepassingen op verschillende gebieden van de wetenschap; Het wordt bijvoorbeeld gebruikt bij de productie van verschillende soorten geneesmiddelen (sedativa, hypnotica, onder andere anticonvulsief), zoals in organische synthese en zelfs in fotografietoepassingen.
Chemische structuur
Natriumbromide wordt gepresenteerd in een vaste fase en, net als vele andere zouten van anorganische aard, heeft het een kristallijne structurele conformatie.
Dit kristallijne molecuul, gevormd door een broom en een van waterstof, heeft een kubieke conformatie gecentreerd op gezichten, zoals haloïde type zouten van hetzelfde metaal (NAI, NAF en NaCl).
Deze moleculaire opstelling vormt de structurele basis van vele verbindingen, waarin de volgorde wordt uitgevoerd zodat elk ion wordt gehandhaafd in het midden van een octaëdrische figuur, zoals weergegeven in het volgende beeld.
Kan u van dienst zijn: fosforzuur (H3PO3)
In dit type glas kunt u zien hoe elk van de ionen er nog eens zes ionen heeft - die een tegengestelde elektrische lading hebben - die zich aan de uiteinden van de octaëdrische figuur bevinden.
Evenzo impliceert de structuur van deze ionische stof dat het een hoog smeltpunt heeft van ongeveer 747 ° C, commercieel in zijn twee vormen: een watervrije soort (zonder watermoleculen) en een dihydrated soort (met twee watermoleculen in zijn structurele formule (Nabr · 2H2O)), waarvan de fusiepunten anders zijn.
Chemische synthese
Natriumbromide ontstaat door de chemische reactie die optreedt tussen waterstofbromide (BRH, een waterstofhalogenide in de gasfase) en natriumhydroxide (NaOH, een sterke basis in vaste fase en met hygroscopische eigenschappen).
Op deze manier wordt het commercieel vervaardigd, waardoor een teveel aan broom wordt toegevoegd aan een NaOH -oplossing. Aldus wordt een bromide/broommengsel gevormd. Vervolgens worden de resulterende producten onderworpen aan verdamping totdat ze droog zijn en worden behandeld met koolstof om de reactie van bromaation te genereren (bro3-) tot het bromide -ion (Br-)).
Neutralisatie
Evenzo kan dit anorganische zout ook optreden door een natriumcarbonaatneutralisatiereactie (NA2CO3) Met brominezuur (hbro3), volgens dezelfde procedure die hierboven is beschreven.
Door een synthese kan deze stof worden geproduceerd door de reactie tussen ijzer met broom en water. Als een product van deze reactie komt de ferro -ferische bromide -soorten uit.
Kan u van dienst zijn: alcoholenVervolgens vormde deze soort (weergegeven als februari2/Februari3) wordt opgelost in water en een bepaalde hoeveelheid natriumcarbonaat wordt toegevoegd. Ten slotte wordt de oplossing gefilterd en gaat het door een verdampingsproces om de natriumbromide eindelijk te verkrijgen.
Natriumbromide -eigenschappen
- Het is meestal in een toestand van vaste aggregatie, in de vorm van wit stof.
- Het heeft een kristallijne structuur, met een moleculaire volgorde in de vorm van kubus gecentreerd op de gezichten.
- Het smeltpunt van deze stof is ongeveer 747 ° C voor watervrij- en 36 ° C -vorm voor zijn dihydraatvorm, met ontleding voordat het smelt.
- Het bestaat uit een natriumion (na+) en een bromide -ion (Br-), met een molaire massa of molecuulgewicht van 102,89 g/mol.
- Het kookpunt is vrij hoog en observeert 1390 ° C (gelijkwaardig aan 2530 ° F of 1660 K).
- De oplosbaarheid van deze soort is ongeveer 94,32 g/100 ml in water bij 25 ° C, waardoor de temperatuur toeneemt.
- Door te ondergaan tot het punt waar het afbreekt, geeft deze stof broomgassen en natriumoxide vrij als giftig.
- De dichtheid van de watervrije vorm van natriumbromide is 3,21 g/cm3, Terwijl de dihydrateerde verbinding 2,18 g/cm is3.
- De oplosbaarheid ervan in alcohol wordt als matig beschouwd, zoals bij andere oplosmiddelen zoals pyridine, ammoniak en hydractie.
- Het presenteert onoplosbaarheid tegen acetonitril en aceton.
Gebruik/toepassingen
- In het medische gebied wordt het gebruikt als een medicijn voor een groot aantal aandoeningen die epileptische aanvallen en als therapie ontstaan om epilepsiefoto's te voorkomen bij patiënten met Wolf-Hirschhorn-syndroom, evenals sedatieve en hypnotische behandelingen.
Het kan u van dienst zijn: brominezuur (hbro3): eigenschappen, risico's en gebruik- In de diergeneeskunde wordt het gebruikt bij honden met stuiptrekkers vanwege de bijwerkingen van medicijnen zoals primidon of fenobarbital.
- Op het gebied van de olie -industrie wordt het gebruikt bij de bereidingsprocessen van bepaalde vloeistoffen van gevarieerde dichtheid die worden gebruikt in oliebronnen.
- Op het gebied van biologisch onderzoek zijn de microbiocide eigenschappen bewezen; dat wil zeggen, het wordt gebruikt om de ontwikkeling van verschillende soorten bacteriën te regelen.
- In bepaalde synthese van het organische type wordt dit anorganische zout gebruikt voor de bereiding van andere soorten die door Bromo zijn gevormd. Door de reactie van Finkelstein bijvoorbeeld worden bepaalde reactiviteitsalkylhalogeniden verkregen, waarvan er een vroeger behoorlijk werd gebruikt in fotografie.
- In het schoonmaak- en desinfectiegebied wordt natriumbromide gebruikt in combinatie met chloor voor de sanitaire voorzieningen van grote hoeveelheden water, zoals in zwembaden en jacuzzis.