Boro -geschiedenis, eigenschappen, structuur, gebruik

- 2153
- 542
- Hugo Crooks
Hij boor Het is een niet -metalen element dat groep 13 van de periodiek systeem kopt en wordt weergegeven met het chemische symbool B. Zijn atoomnummer is 5 en is het enige niet -metalen element in zijn groep; Hoewel sommige chemicaliën het als een metalloïde beschouwen.
Het wordt gepresenteerd als een zwartachtig bruin poeder en bevindt zich in een verhouding van 10 ppm in relatie tot de korst van de aarde. Daarom is het niet een van de meest voorkomende elementen.
 Boro -monster met zuiverheid rond 99%. Bron: Alajhasha [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)]
Boro -monster met zuiverheid rond 99%. Bron: Alajhasha [CC BY-SA 4.0 (https: // creativeCommons.Org/licenties/by-sa/4.0)] Het maakt deel uit van verschillende mineralen zoals borax of natriumboraat, dit is het meest voorkomende boormineraal. Er zijn ook de Kurnite, een andere vorm van natriumboraat; Colemanite of calciumboraat; en de ulexite, natrium- en calciumborato.
Boratos worden geëxtraheerd in de Verenigde Staten, Tibet, China en Chili met een wereldproductie van ongeveer twee miljoen ton per jaar.
Dit element heeft dertien isotopen, die het meest voorkomen elfB, die 80,1% van de boor- en de 10B, dat de resterende 19,9% vormt.
Boron is een essentieel spoor voor planten, die tussenbeide komen in de synthese van sommige vitale planteneiwitten en draagt bij aan waterabsorptie. Bij zoogdieren lijkt het noodzakelijk voor botgezondheid.
Hoewel de boor in 1808 werd ontdekt door de Engelse chemicus Sir Humphry Davy, en Franse chemici Jacques Thérnard en Joseph Gay-Lussac, werd sinds het begin van ons tijdperk in China de borax gebruikt in de uitwerking van aardewerk van enamel.
Boron and its compounds have many uses and applications, ranging from their use in food conservation, especially margarine and fish, until use in the treatment of cancer tumors of the brain, bladder, prostate and other organs and other organs and other organs.
Boron is niet erg oplosbaar in water, maar de verbindingen zijn dat wel. Dit kan een concentratiemechanisme van boor zijn, evenals een bron van vergiftiging met het element.
[TOC]
Geschiedenis
Achtergrond
Sinds de externe tijden heeft de mens boorverbindingen in verschillende activiteiten gebruikt. El Borax, een mineraal dat bekend staat als Tincal, werd in 300 d jaar in China gebruikt.C. In de uitwerking van email -keramiek.
De Perzische alchemist (865-925) maakte de eerste vermelding van Boro-verbindingen. Rhazes classificeerde de mineralen in zes klassen, waarvan er één de borocies was die boor omvatte.
Agricola, rond 1600, rapporteerde het gebruik van borax als een stroom in metallurgie. In 1777 werd de aanwezigheid van boorzuur in een stroom van hete bronnen in de buurt van Florence herkend.
Ontdekking van het element
Humphry Davy, door de elektrolyse van een boraxoplossing, waargenomen de accumulatie van een zwart neerslag in een van de elektroden. Hij verwarmde ook booroxide (B2OF3) Met kalium, het produceren van een zwartachtig bruin poeder dat de bekende vorm van boor was.
Gay-Lussac en Thénard verminderden boorzuur bij hoge temperaturen in aanwezigheid van ijzer om boor te produceren. Ze toonden ook het omgekeerde proces, dat wil zeggen, waarbij boorzuur een product is van booroxidatie.
Identificatie en isolatie
Jöns Jakob Berzelius (1827) bereikte de identificatie van Boro als een nieuw element. In 1892 slaagde de Franse chemicus Henri Moissan erin om boor te produceren met 98% zuiverheid. Hoewel, er wordt op gewezen dat Boron puur werd geproduceerd door de Amerikaanse chemicus Ezechiël Weintraub, in 1909.
Eigenschappen
Fysieke beschrijving
Kristallijn vast of zwartbruin amorf poeder.
Kan u van dienst zijn: peroxiden: eigenschappen, nomenclatuur, gebruik, voorbeeldenMolaire massa
10.821 g/mol.
Smeltpunt
2076 ºC.
Kookpunt
3927 ºC.
Dikte
-Vloeistof: 2,08 g/cm3.
-Kristallijn en amorf bij 20 ºC: 2,34 g/cm3.
Fusiewarmte
50,2 kJ/mol.
Verdampingswarmte
508 kJ/mol.
Molaire caloriecapaciteit
elf.087 J/(mol · k)
Ionisatieenergie
-Eerste niveau: 800.6 kJ/mol.
-Tweede niveau: 2.427 kJ/mol.
-Derde niveau: 3.659,7 kJ/mol.
Elektronegativiteit
2.04 op de Pauling -schaal.
Atomaire radio
210 PM (empirisch).
Atoomvolume
4.16 cm3/mol.
Warmtegeleiding
27.4 w/m.K
Elektrische weerstand
~ 106 Ω.M (bij 20 ° C).
Hoge temperaturen Boron is een goede elektrische geleider, maar bij omgevingstemperatuur wordt het bijna een isolator.
Hardheid
~ 9.5 op de mohs -schaal.
Reactiviteit
Boron wordt niet beïnvloed door zoutzuur bij kooktemperatuur. Het wordt echter omgezet door heet salpeterzuur tot boorzuur (h3Bo3)). Boro gedraagt zich chemisch als een niet -metaal.
Reageert met alle halogenen om trihaluros te geven, zeer reactief. Deze hebben de algemene formule bx3, Waarbij x het halogeen vertegenwoordigt.
Het wordt gecombineerd met verschillende elementen om boruros te ontstaan. Sommigen van hen behoren tot de stoffen van grotere hardheid; Bijvoorbeeld boornitride (BN). Boron wordt gecombineerd met zuurstof om boortrioxide te vormen.
Elektronische boorstructuur en configuratie
Links en structurele eenheden in Boron
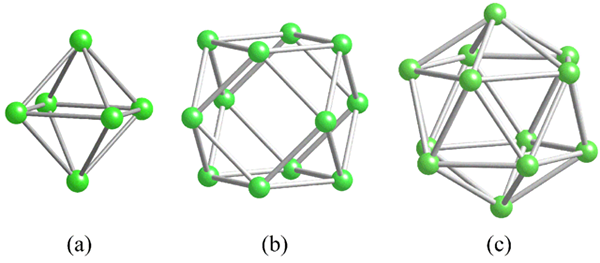 Geometrieën van de gemeenschappelijke structurele eenheden voor boor. Bron: MaterialScientist [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]
Geometrieën van de gemeenschappelijke structurele eenheden voor boor. Bron: MaterialScientist [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)] Voordat u boorstructuren (kristallijn of amorf) aanpakt, is het essentieel om te onthouden hoe hun atomen kunnen worden gekoppeld. De B-B-link is in covalent essentie; Niet alleen dat, maar omdat boroatomen natuurlijk een elektronisch tekort hebben, zullen ze proberen het op de een of andere manier in hun links te leveren.
In de boor is er een speciaal type covalente binding: dat van drie centra en twee elektronen, 3C2E. Hier delen drie booratomen twee elektronen, en definiëren een driehoek, een van de vele gezichten gevonden in hun structurele polyhedros (superieur beeld).
Van links naar rechts hebben we: octaedro (a, b6), Cuboctaedro (B, B12) En de isocasedro (C, B12 Ook). Al deze eenheden delen een functie: ze zijn slecht in elektronen. Daarom moeten ze covalent onderling koppelen; En het resultaat is een verrassende linkfeest.
In elke driehoek van deze polyhedros is de 3C2E -link aanwezig. Anders kon niet worden uitgelegd hoe Boron, in staat om slechts drie covalente bindingen te vormen volgens de Valencia Link -theorie, maximaal vijf links kunnen hebben in deze polyedrale eenheden.
De boorstructuren bestaan vervolgens uit een opstelling en herhaling van deze eenheden die uiteindelijk een kristal definiëren (of een amorfe vaste stof).
Boro α-Romboédrico
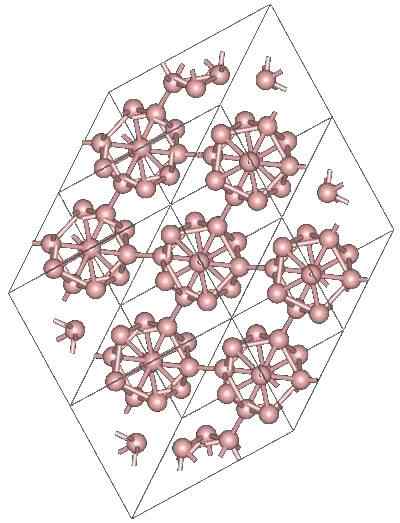 Kristallijne structuur van de α-Romboédico Boron Alotropic. Bron: MaterialScientist bij Engelse Wikipedia [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]
Kristallijne structuur van de α-Romboédico Boron Alotropic. Bron: MaterialScientist bij Engelse Wikipedia [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)] Er kunnen andere polyedrale eenheden van Boro zijn, evenals een verbinding alleen door twee atomen, b2; Een boor "lijn" die moet worden gekoppeld aan andere atomen na het hoge elektronische tekort.
De Icosaedro is veruit de voorkeurseenheid van de boor; Degene die zich beter voelt. In de bovenste afbeelding wordt bijvoorbeeld op prijs gesteld hoe deze B -eenheden12 Ze verweven verweven om het rhombohedrale kristal van de boor-a te definiëren.
Als een van die ICOSAedros geïsoleerd wilde worden, zou dit een ingewikkelde taak zijn, omdat hun elektronische tekort hen dwingt een kristal te definiëren waarbij elk de elektronen levert die de andere buren nodig hebben.
Β-Romboédrico Boron
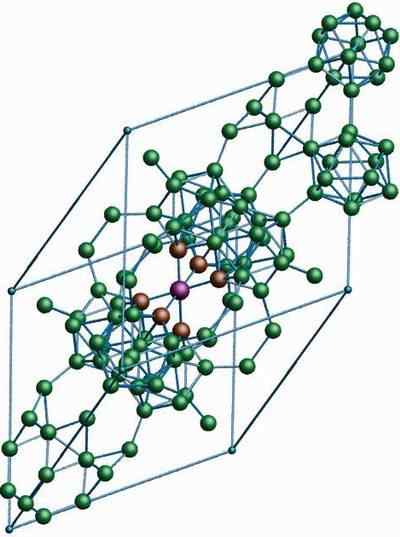 Kristallijne structuur van de β-romboédrico boor alotrope. Bron: MaterialScientist bij Engelse Wikipedia [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]
Kristallijne structuur van de β-romboédrico boor alotrope. Bron: MaterialScientist bij Engelse Wikipedia [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)] De β-Romboédrico boron Alotropic, zoals de naam al aangeeft, heeft rhomboédica-kristallen en boor-a; Het verschilt echter in zijn structurele eenheden. Het ziet eruit als een buitenaards schip gemaakt met booratomen.
Het kan u van dienst zijn: lithiumhydroxide (liOH)Als u de icosaërische eenheden op een discrete en samengevoegde manier zorgvuldig kunt zien (in het midden). Er zijn ook B -eenheden10 en eenzame booratomen die fungeren als een brug voor de bovengenoemde eenheden. Dit is de meest stabiele boor alotroop.
Boro-γ GEMA
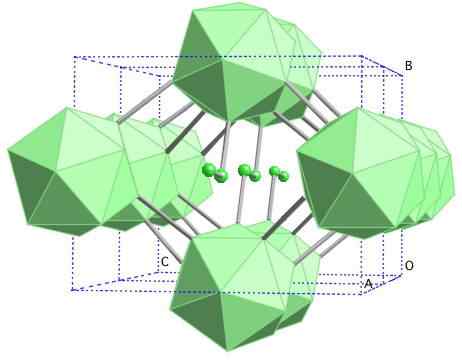 Kristallijne structuur van boor-y. Bron: MaterialScientist bij Engelse Wikipedia [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]
Kristallijne structuur van boor-y. Bron: MaterialScientist bij Engelse Wikipedia [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)] In deze boor alotroop zijn eenheden B gecoördineerd2 en B12. De B2 presenteert zoveel elektronische tekortkoming dat in feite elektronen uit B verwijdert12 En er is daarom een ionisch karakter in deze vaste stof. Dat wil zeggen, ze zijn niet alleen covalent verenigd, maar er is type elektrostatische aantrekkingskracht [B2-] [B12+].
Boro-γ kristalliseert in een GEMA-zoutstructuur, hetzelfde als voor NaCl. Andere alotropen van boor tot hoge druk (20 GPa) en temperaturen (1800 ° C) worden verkregen en blijven vervolgens stabiel in normale omstandigheden. De feitelijke stabiliteit concurreert met die van β-Romboédrico Boron.
Kubiek en amorf
Andere alotropen van de boor bestaan uit aggregaten van B -atomen alsof ze worden verenigd door een metaalbinding, of alsof het ionische kristallen waren; dat wil zeggen, het is een kubieke boor.
Ook, en niet in het minst, is de amorfe boor, wiens beschikking over B -eenheden12 Het is willekeurig en rommelig. Het wordt gepresenteerd als een fijn of glasachtig poeder van donkere kleuren en ondoorzichtig bruin.
Borofenos
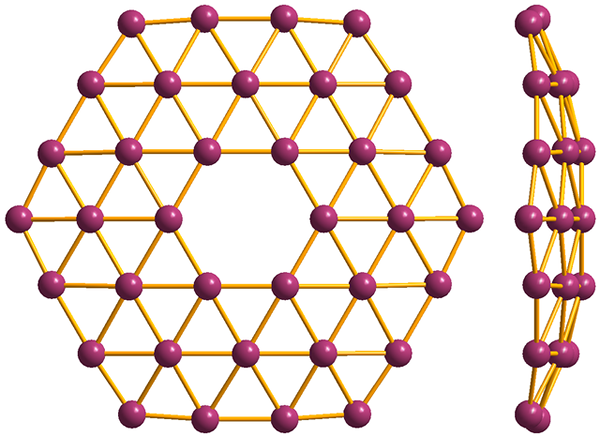 Structuur van de eenvoudigste van de Borofenos, de B36. Bron: MaterialScientist [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]
Structuur van de eenvoudigste van de Borofenos, de B36. Bron: MaterialScientist [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)] En ten slotte is de meest nieuwe en bizarre alotrope van Boro: Borofenos (hoger beeld). Het bestaat uit een apenlaag van booratomen; extreem dun en analoog aan grafeen. Merk op dat het de beroemde driehoeken behoudt, kenmerkend voor het elektronische tekort dat zijn atomen lijden.
Naast de borofenos, waarvan de B36 Het is de eenvoudigste en kleine, er zijn ook Boro's clusters. Borosfereen (afbeelding hieronder) bestaat uit een sferische kooi vergelijkbaar met een bal van veertig atomen van boro, b40; Maar in plaats van gladde randen te hebben, zijn ze abrupt en onregelmatig:
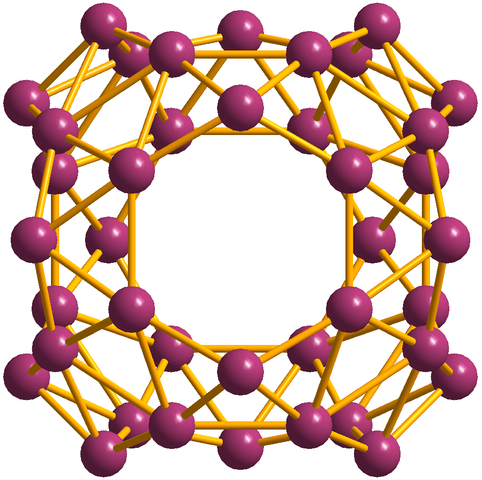 Borosferenos -eenheid, B40. Bron: MaterialScientist [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]
Borosferenos -eenheid, B40. Bron: MaterialScientist [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)] Elektronische configuratie
De elektronische configuratie van de boor is:
[Hij] 2s2 2 p1
Daarom drie elektronen uit Valencia. Hij mist er nog vijf om zijn octeto Valencia te voltooien, en hij kan nauwelijks drie covalente banden vormen; Ik zou een vierde dative -link nodig hebben om je octet te voltooien. Boron kan zijn drie elektronen verliezen om een oxidatietoestand van +3 te verwerven.
Het verkrijgen van
Boron wordt geïsoleerd door boorzuur te verminderen met magnesium of aluminium; Methode vergelijkbaar met Gay-Lussac en Thénard. Het heeft de moeilijkheid van boorvervuiling met de boruros van die metalen.
Een monster met een hoge zuiverheid kan worden verkregen door een gasvormige reductie van boortrichloride of tribromide, met waterstof op elektrisch tanrisch verwarmde filamenten.
Een boor met hoge zuiverheid wordt bereid door ontleding bij hoge Diborano -temperaturen, gevolgd door zuivering door fusie van zone- of czocharalski -processen.
Toepassingen
In de industrie
Elementair boor is gebruikt bij het verharden van staal. In een legering met het ijzer dat een boor tussen 0,001 en 0,005 % bevat. Het wordt ook gebruikt in de niet -ferrous industrie, meestal als deoxidant.
Bovendien wordt boron gebruikt als een modderige in koper gebaseerde legeringen en koper met een hoog geleidingsmiddel. In de halfgeleiderindustrie worden kleine hoeveelheden boro toegevoegd als dopingagent van silicium en germanio.
Kan u van dienst zijn: isopreno: structuur, eigenschappen, toepassingenBoro -oxide (B2OF3) wordt gemengd met silica om een hittebestendig glas te maken (borosylicaat glas), gebruikt in keukengerei en bepaald laboratoriumapparatuur.
Boro Carbide (B4C) Het is een extreem harde stof die wordt gebruikt als schurende en versterkingsmiddel in samengestelde materialen. Aluminium boruro (alb12) Het wordt gebruikt als een Diamond Dust -vervanging voor mat en gepolijst.
Boro wordt gebruikt in legeringen, bijvoorbeeld in zeldzame aardmagneten, legering met ijzer en neodymium. De gevormde magneten worden gebruikt bij de productie van microfoons, magnetische schakelaars, hoofdtelefoons en deeltjesversnellers.
In de geneeskunde
De capaciteit van de Boro-10 isotoop (10B) Om neutronen te vangen, is het uitzenden van a -type straling gebruikt voor de behandeling van hersentumoren in een techniek die bekend staat als boor -neutronenvangstherapie (BNCT).
Hij 10B in de vorm van verbindingen wordt verzameld in de kankerachtige tumor. Vervolgens wordt de tumorzone met neutronen uitgestraald. Deze interageren met 10B, wat de emissie van α -deeltjes veroorzaakt. Deze deeltjes hebben een hoog relatief biologisch effect en vanwege hun grote omvang hebben ze weinig bereik.
Dus de destructieve werking van α -deeltjes is beperkt in tumorcellen, waardoor hun vernietiging wordt uitgevoerd. BNCT wordt ook gebruikt bij de behandeling van nek-, lever-, blaas- en prostaattumoren.
Biologische actie
Een kleine hoeveelheid boorzuur of boraatvormige boor is noodzakelijk voor de groei van veel planten. Een boortekort manifesteert zich in vervormde groei van planten; het "bruine hart" van groenten; en de "droge rot" van suikerbiet.
Boor kan in kleine hoeveelheden nodig zijn om de gezondheid van het bot te behouden. Er zijn studies die aangeven dat gebrek aan boor betrokken zou zijn bij het genereren van artritis. Het zou ook ingrijpen in hersenfuncties zoals geheugen en coördinatie eye-man.
Sommige experts wijzen erop dat 1,5 tot 3 mg boor moet worden opgenomen in het dagelijkse dieet.
Risico's en voorzichtigheid
Boor, booroxide, boorzuur en boratos worden beschouwd als niet -toxisch. De LD50 voor dieren is 6 g boor/kg lichaamsgewicht, terwijl stoffen met een LD50 groter dan 2 g/kg lichaamsgewicht worden beschouwd als niet -toxisch.
Aan de andere kant veroorzaakt de consumptie van meer dan 0,5 mg/boordag gedurende 50 dagen kleine spijsverteringsproblemen, wat wijst op toxiciteit. Sommige rapporten wijzen erop dat een overmaat in de boorinname het functioneren van de maag, de lever, de nieren en de hersenen kan beïnvloeden.
Evenzo zijn irriterende effecten op korte termijn aangegeven in de nasofarynx, de bovenste luchtwegen en de ogen voor blootstelling aan boor.
De rapporten over de toxiciteit van boor zijn schaars en in veel gevallen wordt toxiciteit gepresenteerd in zeer hoge doses, hoger dan de algemene bevolking is blootgesteld.
De aanbeveling is om het boorgehalte van voedsel te controleren, vooral groenten en fruit. Gezondheidsinstanties van de overheid moeten controleren dat de concentratie van de waterboor van de waterboor niet hoger is dan de toegestane limieten.
Werknemers die worden blootgesteld aan stof met boor, moeten maskers dragen die de luchtwegen, handschoenen en speciale laarzen beschermen.
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). MC Graw Hill.
- Wikipedia. (2019). Allotropen van boor. Opgehaald uit: in.Wikipedia.borg
- Profit. Robert J. Lancashire. (2014). Lezing 5B. Structuur van de elementen (niet-metalen, B, C). De afdeling Chemie, Universiteit van West -Indië, Mona Campus, Kingston 7, Jamaica. Hersteld van: chem.Uwimona.Edu.JM
- Manisha Lalloo. (28 januari 2009). Ultra-boor boorstructuur ontdekt. Wereldchemie. Hersteld van: chemieworld.com
- Belwentelijkheid. (16 december 2018). Een profiel van de metalen boor. Hersteld van: Thalance.com
- De redacteuren van Enyclopaedia Britannica. (2019). Boor. Hersteld van: Britannica.com
- Agentschap voor giftige stoffen en ziektegister. (2010). Toxfaqs ™ op Boron. [PDF]. Opgehaald van: ATSDR.CDC.Gov
- Helmestine, Anne Marie, pH.D. (6 februari 2019). Boron Chemical & Physical Properties. Hersteld van: Thoughtco.com

