Anhydrides

- 620
- 71
- Hugo Crooks
Wat zijn anhydriden?
De Anhydrides Het zijn chemische verbindingen die afkomstig zijn van de vereniging van twee moleculen door bevrijding van water. Het kan dus worden gezien als een uitdroging van de initiële stoffen; Hoewel het niet precies waar is.
In de organische en anorganische chemie worden ze genoemd, en in beide takken verschilt hun begrip in een merkbare mate. In anorganische chemie worden bijvoorbeeld beschouwd als basis- en zuuroxiden zoals anhydries van hun hydroxiden en zuren, omdat de eerste reageert met water om de tweede te vormen.
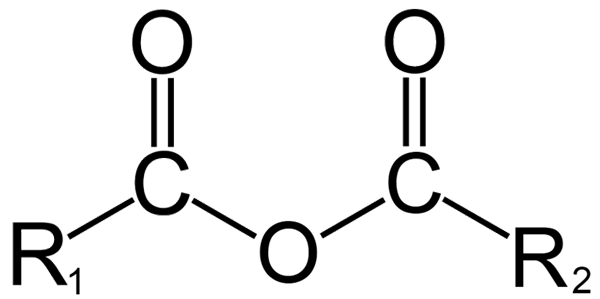 Algemene structuur van anhydriden. Bron: DremmetBrownie [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)], van Wikimedia Commons
Algemene structuur van anhydriden. Bron: DremmetBrownie [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)], van Wikimedia Commons Hier kan een verwarring tussen de termen 'watervrij' en 'anhydrido' worden gegenereerd. Over het algemeen verwijst watervrij naar een verbinding waarnaar het is uitgedroogd zonder veranderingen in zijn chemische aard (er is geen reactie); Terwijl met een anhydride een chemische verandering is, weerspiegeld in de moleculaire structuur.
Als de overeenkomstige hydroxiden en zuren (of anhydriden) worden vergeleken, zal worden waargenomen dat er een reactie was. Aan de andere kant kunnen sommige oxiden of zouten gehydrateerd zijn, water verliezen en dezelfde verbindingen blijven; Maar zonder water, dat wil zeggen anhydros.
In de organische chemie daarentegen is wat wordt begrepen door anhydride de eerste definitie. Een van de bekendste anhydriden is bijvoorbeeld die afgeleid van carbonzuren (superieur beeld). Deze bestaan uit de vereniging van twee acylgroepen (-RCO) via een zuurstofatoom.
In zijn algemene structuur wordt R aangegeven1 Voor een acylgroep, en r2 Voor de tweede Acilo -groep. Omdat r1 en r2 Ze zijn verschillend, komen uit verschillende carbonzuren en dan is het een asymmetrische zuuranhydride. Wanneer beide substituenten R (of aromatisch) hetzelfde zijn, is er in dat geval gesproken van een symmetrisch zuuranhydride.
Op het moment van het koppelen van twee carbonzuren om anhydride te vormen, kan water al dan niet vormen, evenals andere verbindingen. Alles hangt af van de structuur van deze zuren.
Anhydrid -eigenschappen
De eigenschappen van anhydrides zijn afhankelijk van naar wie men verwijst. Bijna iedereen heeft gemeen dat ze met water reageren. Voor de zo -aangedekte basisanhydriden in anorganisch zijn er echter een aantal van hen zelfs onoplosbaar in water (MGO), dus deze verklaring zal zich richten op de anhydriden van carbonzuren.
Fusie- en kookpunten vallen op de moleculaire structuur en intermoleculaire interacties voor (RCO)2Of dit is de algemene chemische formule van deze organische verbindingen.
Als de moleculaire massa van (RCO)2Of het is laag, het is waarschijnlijk een kleurloze vloeistof bij kamertemperatuur en druk. Bijvoorbeeld azijnzuuranhydride (of ehydridge3CO)2Of het is een vloeistof en het belangrijkste industriële belang, de productie is erg enorm.
De reactie tussen azijnzuuranhydride en water wordt weergegeven door de volgende chemische vergelijking:
(Ch3CO)2Of + h2O => 2CH3COOH
Merk op dat wanneer het watermolecuul wordt toegevoegd, twee azijnzuurmoleculen worden vrijgegeven. De omgekeerde reactie kan echter niet optreden voor azijnzuur:
Kan u van dienst zijn: evenwicht tussen vloeistof en damp2CH3COOH => (cho3CO)2Of + h2Of (gebeurt niet)
Het is noodzakelijk om hun toevlucht te nemen tot een andere synthetische route. Dicarbonzuren kunnen daarentegen dit doen door te verwarmen; Maar het zal in de volgende sectie worden uitgelegd.
Chemische reacties
Hydrolyse
Een van de eenvoudigste reacties van anhydriden is hun hydrolyse, die zojuist is aangetoond voor azijnzuuranhydride. Naast dit voorbeeld is er dat van zwavelzuuranhydride:
H2S2OF7 + H2Of 2H2SW4
Hier heb je een anhydride anhydride. Merk op dat voor h2S2OF7 (ook wel disulfurinezuur genoemd), de reactie is omkeerbaar, dus verwarming h2SW4 Concentratie resulteert in de vorming van zijn anhydride. Als het aan de andere kant een verdunde oplossing van h is2SW4, Het wordt zo uitgebracht3, Zwavelanhydride.
Verestering
Zure anhydriden reageren met alcoholen, met pyridine in het midden, om aanleiding te geven tot een ester en een carbonzuur. De reactie tussen azijnzuuranhydride en ethanol wordt bijvoorbeeld overwogen:
(Ch3CO)2Of + ch3Ch2OH => Cho3CO2Ch2Ch3 + Ch3COOH
Dus het vormen van de ethylethaanester, CH3CO2Ch2Ch3, en ethaanzuur (azijnzuur).
Praktisch wat er gebeurt is de vervanging van de waterstof van de hydroxylgroep, door een Aquilus -groep:
R1-Oh => r1-Ocor2
In het geval van (ch3CO)2Of, uw Acilo -groep is de -coch3. Daarom wordt gezegd dat de OH -groep acilatie ondergaat. Acilatie en verestering zijn echter geen uitwisselbare concepten; Acilatie kan direct optreden in een aromatische ring, bekend als Friedel-Crafts-acilatienaam.
Aldus worden alcoholen in de aanwezigheid van zuuranhydriden verdeeld door acilatie.
Aan de andere kant reageert slechts één van de twee zure groepen met alcohol, de andere blijft met waterstof die een carbonzuur vormt; dat in het geval van (cho3CO)2Of het is ethaanzuur.
Amidatie
Zure anhydriden reageren met ammoniak of amines (primair en secundair), om aanleiding te geven tot amiden. De reactie lijkt erg op de nieuw beschreven verestering, maar de ROH wordt vervangen door een amine; Bijvoorbeeld een secundaire amina, r2NH.
Nogmaals, de reactie tussen (ch3CO)2Of en diethylamine, ET2NH:
(Ch3CO)2O + 2et2NH => ch3Vervelen2 + Ch3Coo- +NH2ET2
En diethilacetamide worden gevormd, cho3Vervelen2, en een gearboxyleerd ammoniumzout, cho3Coo- +NH2ET2.
Hoewel de vergelijking misschien een beetje moeilijk te begrijpen lijkt, is het voldoende om te observeren hoe de groep -coch3 Vervang de H van een ET2NH om de Amida te vormen:
ET2NH => ET2Ncoch3
Meer dan een amidatie is de reactie nog steeds acilatie. Alles is samengevat in dat woord; Deze keer lijdt het amina aan acilatie en geen alcohol.
Hoe zijn anhydriden?
Anorganische anhydriden worden gevormd door het element te reageren met zuurstof. Dus als het element metaalachtig is, wordt een basisch metaaloxide gevormd; En als het niet -metaal is, wordt een niet -metalen oxide of zuuranhydride gevormd.
Het kan u van dienst zijn: Clausius-Claapeyron-vergelijking: waar is het voor, voorbeelden, oefeningenVoor organische anhydriden is de reactie een andere. Twee carbonzuren kunnen niet rechtstreeks meedoen om water vrij te geven en anhydridezuur te vormen; De deelname van een verbinding die nog niet is genoemd: het acylchloride, RCOCL is noodzakelijk.
Carbonzuur reageert met zuurchloride, waardoor het respectieve anhydride en waterstofchloride worden geproduceerd:
R1Cocl + R2COOH => (R1CO) of (cor2) + HCl
Ch3Cocl + ch3COOH => (cho3CO)2O + HCl
Een ch3 komt uit de acetylgroep, Cho3Co- en de andere is al aanwezig in azijnzuur. De keuze van een specifiek zuurchloride, evenals carbonzuur, kan aanleiding geven tot de synthese van een symmetrische of asymmetrische zuuranhydride.
Cyclische anhydriden
In tegenstelling tot de andere carbonzuren die zuurchloride vereisen, kunnen dicarbonzuren condenseren in hun overeenkomstige anhydride. Om dit te doen, is het noodzakelijk om ze te verwarmen om de afgifte van h te bevorderen2OF. De vorming van ftalisch anhydride wordt bijvoorbeeld getoond uit fotozuur.
 Fthalical anhydride vorming. Bron: Jü [Public Domain], van Wikimedia Commons
Fthalical anhydride vorming. Bron: Jü [Public Domain], van Wikimedia Commons Merk op hoe de Pentagonal Ring is voltooid en de zuurstof die samen met beide groepen C = O verbindt, maakt er deel van uit; Dit is een cyclisch anhydride. Het is ook te zien dat het ftalische anhydride een symmetrische anhydride is, omdat zoveel r1 zoals r2 Ze zijn identiek: een aromatische ring.
Niet alle dicarbonzuren kunnen hun anhydride vormen, omdat wanneer hun COOH -groepen zeer gescheiden zijn, ze gedwongen worden om steeds grotere ringen te voltooien. De grootste ring die kan worden gevormd, is een zeshoekig, groter dan dat de reactie niet plaatsvindt.
Nomenclatuur
Hoe heet Anhydrides? Afgezien van de anorganische, relevante voor oxideproblemen, zijn de namen van organische anhydriden die zo ver uitleggen, afhankelijk van de identiteit van R1 en r2; dat wil zeggen van zijn acylgroepen.
Als de twee r hetzelfde zijn, is het voldoende om het woord 'zuur' te vervangen door 'anhydrid' in de respectieve naam van carbonzuur. En als de twee R integendeel anders zijn, worden ze in alfabetische volgorde genoemd. Daarom moet je eerst zien hoe je het moet noemen als het een symmetrische of asymmetrische anhydride is.
De ch3CO)2Of het is symmetrisch, omdat r1= R2 = Ch3. Het is afgeleid van azijnzuur of ethaanzuur, dus de naam is, volgt de vorige uitleg: azijnzuur of ethanoïsche anhydride. Hetzelfde gebeurt met de zojuist genoemde fthalische anhydride.
Stel dat u de volgende anhydride heeft:
Ch3CO (O) Coch2Ch2Ch2Ch2Ch2Ch3
De acetylgroep aan de linkerkant komt van azijnzuur, en dat aan de rechterkant van heptaanzuur. Om dit anhydride te noemen, moet u zijn R -groepen in alfabetische volgorde aanwijzen. Dus zijn naam is: heptanoïde azijnzuuranhydride.
Toepassingen
Anorganische anhydriden hebben eindeloze toepassingen, van de synthese en formulering van materialen, keramiek, katalysatoren, cement, elektroden, meststoffen, enz., Tot als coating van de korst van de aarde met zijn duizenden ijzer- en aluminiummineralen, en de koolstofdioxide uitademd door levende organismen.
Kan u van dienst zijn: Decantation: concept, voorbeelden en typenZe vertegenwoordigen de startbron, het punt waar veel verbindingen die in de anorganische synthese worden gebruikt, afgeleid. Een van de belangrijkste anhydriden is die van koolhydraten, CO2. Het is, samen met het water, essentieel voor fotosynthese. En op industrieel niveau, de SO3 Het is essentieel omdat het verdachte zwavelzuur er uit wordt verkregen.
Misschien is anhydride met meer toepassingen en voor het hebben (zolang er leven is) er een van fosforzuur: adenosine tryposfaat, beter bekend als ATP, aanwezig in DNA en "energievaluta" van het metabolisme.
Organische anhydriden
Zure anhydriden reageren door acylering, hetzij op een alcohol, het vormen van een ester, een amine, die aanleiding geeft tot een amida of een aromatische ring.
Er zijn miljoenen van elk van deze verbindingen en honderdduizenden carbonzuuropties om een anhydride te bereiden; Daarom groeien synthetische mogelijkheden drastisch.
Een van de belangrijkste toepassingen is dus om een zure groep in een verbinding op te nemen, ter vervanging van een van de atomen of groepen van zijn structuur.
Elke dioxide heeft afzonderlijk zijn eigen toepassingen, maar in algemene termen reageren ze allemaal op een vergelijkbare manier. Om die reden worden dit soort verbindingen gebruikt om polymere structuren te wijzigen, waardoor nieuwe polymeren worden gecreëerd; dat wil zeggen, copolymeren, harsen, coatings, enz.
Azijnzuuranhydride wordt bijvoorbeeld gebruikt om alle cellulose OH -groepen (lagere afbeelding) te acetilleren. Hiermee wordt elke H van de OH vervangen door een acetylgroep, Coch3.
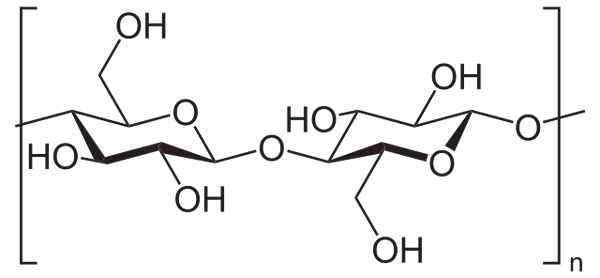 Cellulose. Bron: Neurotoger [Public Domain], van Wikimedia Commons
Cellulose. Bron: Neurotoger [Public Domain], van Wikimedia Commons Op deze manier wordt het celluloseacetaatpolymeer verkregen. Dezelfde reactie kan worden geschetst met andere polymere structuren met NH -groepen2, Ook vatbaar voor acilatie.
Deze acilatiereacties zijn ook nuttig voor geneesmiddelsynthese, zoals aspirine (zuur acetylsalicylisch).
Voorbeelden
Ze blijken enkele andere voorbeelden van organische anhydries af te maken. Hoewel ze ze niet zullen vermelden, kunnen zuurstofatomen worden vervangen door zwavel, waardoor gesulfuriseerde anhydriden of zelfs fosfor worden gegeven.
-C6H5CO (O) Kook6H5: Benzoïsche anhydride. Groep C6H5 vertegenwoordigt een benzeenring. De hydrolyse produceert twee benzoïnezuren.
-HCO (O) COH: Formische Anhydrid. De hydrolyse produceert twee mierenzuren.
- C6H5CO (O) Coch2Ch3: Propanoic benzoïsche anhydride. De hydrolyse produceert benzoïsche en propaniczuren.
-C6HelfCO (O) Kook6Helf: Cyclohexanocroboxylicanight Anhydrid. In tegenstelling tot aromatische ringen zijn deze verzadigd, zonder dubbele links.
-Ch3Ch2Ch2CO (O) Coch2Ch3: Propanoic butanische anhydride.
Succinisch anhydride
 Succinisch anhydride. Bron: Ninjatacoshell [Public Domain], van Wikimedia Commons
Succinisch anhydride. Bron: Ninjatacoshell [Public Domain], van Wikimedia Commons Hier heb je nog een cyclisch, afgeleid van succeszuur, een dicarbonzuur. Opmerking zoals de drie zuurstofatomen verraden de chemische aard van dit type verbinding.
De anhydride maleico lijkt erg op die van de succinische, met het verschil dat er een dubbele band is tussen de koolstofatomen die de basis van het Pentagon vormen.
Glutarisch anhydride
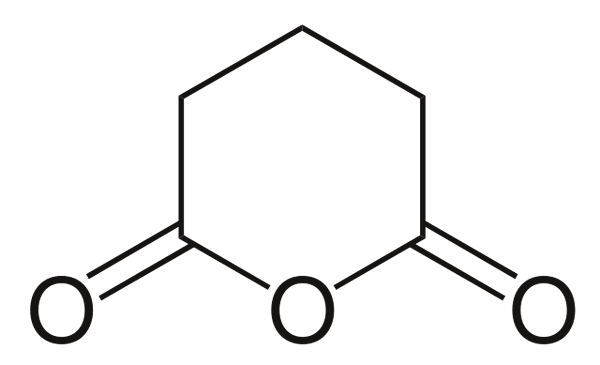 Glutarisch anhydride. Bron: Choij [Public Domain], van Wikimedia Commons
Glutarisch anhydride. Bron: Choij [Public Domain], van Wikimedia Commons En ten slotte wordt het anhydride van glutaarzuur getoond. Dit onderscheidt alle anderen structureel door te bestaan uit een zeshoekige ring. Nogmaals, de drie zuurstofatomen vallen op in de structuur.
Andere meer complexe anhydriden kunnen altijd worden bewezen door de drie zuurstofatomen die heel dicht bij elkaar zijn.
Referenties
- Anhydride. Enclyclopaedia Britannica. Hersteld van: Britannica.com
- Zuuranhydride definitie in de chemie. Hersteld van: Thoughtco.com

