Amilase -kenmerken, classificatie, structuur, functies
- 742
- 31
- Kurt Aufderhar Jr.
Amylase Het is de term die wordt gebruikt om een belangrijke groep enzymen te identificeren die verantwoordelijk is voor de hydrolyse van glucosidebindingen tussen glucosemoleculen die aanwezig zijn in koolhydraten, zoals gerelateerde zetmeel en andere, die worden ingenomen in het dieet van veel levende organismen.
Dit type enzymen wordt geproduceerd door bacteriën, schimmels, dieren en planten, waar ze in principe dezelfde reacties katalyseren en gevarieerde functies hebben, voornamelijk gerelateerd aan energiemetabolisme.
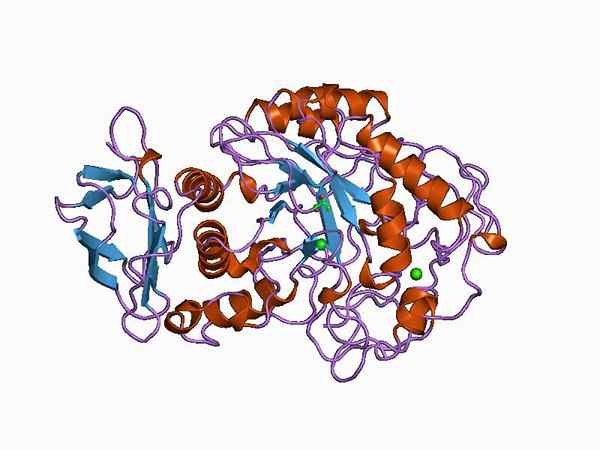
 Grafische weergave van een alfa -ammilase van dierlijke oorsprong (Bron: Jawahar Swaminathan en MSD -personeel van het European Bioinformatics Institute [Public Domain] via Wikimedia Commons)
Grafische weergave van een alfa -ammilase van dierlijke oorsprong (Bron: Jawahar Swaminathan en MSD -personeel van het European Bioinformatics Institute [Public Domain] via Wikimedia Commons) De producten van de hydrolyse -reacties van de glucosidische bindingen kunnen als kenmerkend worden beschouwd voor elk type amylolithisch enzym, zo vaak is dit een belangrijke parameter voor classificatie.
Het belang van deze enzymen, antropocentrisch gesproken, is niet alleen fysiologisch, omdat dit type enzymen momenteel een grote biotechnologische transcendentie heeft, zowel in de industriële productie van voedsel, papier, textiel, suikers, suikers en andere.
De term "amylase" komt voort uit het Grieks "Amylon", wat zetmeel betekent, en werd bedacht in 1833 door wetenschappers Payen en Persoz, die de hydrolytische reacties van dit enzym op het zetmeel bestudeerden.
[TOC]
Kenmerken
Sommige amylasen in de natuur zijn multimeer, zoals β-amylase zoete zoete aardappelen, die zich gedraagt als een tetroar. Het geschatte molecuulgewicht van de amylase -monomeren is echter voor het bereik van 50 kDa.
Over het algemeen hebben zowel groente -enzymen als dieren een relatief "gemeenschappelijke" aminozuursamenstelling en hebben ze optimale pH -activiteiten tussen 5.5 en 8 eenheden (de meest actieve dieramylasen zijn tot pH meer neutraal).
Amilasa's zijn enzymen die in staat zijn om glucosidebindingen van een groot aantal polysachariden te hydrolyseren, die in het algemeen disacchariden produceren, maar zijn niet in staat om complexen zoals cellulose te hydrolyseren.
Kan u van dienst zijn: disacchariden: kenmerken, structuur, voorbeelden, functiesSubstraatkenmerken
De reden waarom ililasa's zo belangrijk van aard zijn, vooral bij de vertering van koolhydraten, is gerelateerd aan de alomtegenwoordige aanwezigheid van hun natuurlijke substraat (zetel) in de weefsels van "hogere" groenten, die dienen als een bron van voedsel voor meerdere soorten voor meerdere soorten voor meerdere soorten Dieren en micro -organismen.
Dit polysacharide is op zijn beurt samengesteld uit twee macromoleculaire complexen bekend als amylose (onoplosbaar) en amylopectine (oplosbaar). Amilosa-gedeelten bestaan uit lineaire glucoseafvallijnen verenigd door α-1,4-links en worden afgebroken door a-amylasen.
AmilPectin is een samenstelling met een hoog molecuulgewicht, het bestaat uit vertakte glucoseafvalketens verenigd door α-1,4-bindingen, waarvan de gevolgen worden gehandhaafd door α-1,6 bindingen.
Classificatie
Amilasas -enzymen worden geclassificeerd volgens de site waar ze in staat zijn om glucosidebindingen zoals endoamilasas of exoamilasa te verbreken. De eerste hydrolys -links in interne koolhydratengebieden, terwijl deze laatste alleen de hydrolyse van afval aan de uiteinden van polysachariden kan katalyseren.
Bovendien is de traditionele classificatie gerelateerd aan de stereochemie van haar reactieproducten, dus deze eiwitten met enzymatische activiteit worden ook geclassificeerd als a-amylasen, β-amylasen of y-amylasen.
-De a-amylasen (α-1,4-glucan.
-De β-amylasen (α-1,4-glucan maltohydroles) zijn groente-exoamilasa's die werken op bindingen aan de niet-reducerende uitersten van polysacchariden zoals zetmeel en waarvan de hydrolytische producten β-maltose residuen zijn.
-Ten slotte zijn de γ-amylasen een derde klasse amylasen die ook glucoamilasa's (α-1,4-glycan glycohydroles) worden genoemd die, net als β-amylasen, exoamilasas zijn die in staat zijn om eenvoudige glucose-eenheden van de niet-reducerende uiteinden van de polysacchariden en investeren te verwijderen en te investeren Hun configuratie.
Deze laatste klasse enzymen kan zowel a-1,4-bindingen als α, 1-6 links, het draaien van substraten en D-glucosa zetmeel hydrolyseren. Bij dieren zijn ze voornamelijk in leverweefsel.
Kan u van dienst zijn: virulentiefactorenHuidige classificatie
Met de komst van de nieuwe biochemische analysetechnieken van zowel enzymen als hun substraten en producten, hebben bepaalde auteurs vastgesteld dat er minstens zes soorten amylaous enzymen zijn:
1-endoAmilasas die glucosidische glucosidische verbindingen α-1,4 hydrolyseren en die kunnen "overslaan" (Skip "(bypass) Koppelt α-1,6. Voorbeeld van deze groep zijn de a-amylasen.
2-exoamilasas in staat tot hydrolys. Groepsvoorbeeld zijn β-amylasen.
3-exoAmilasas die in staat zijn om a-1,4 en α-1,6 bindingen zoals ililoglucosidasen (glacoamilasa) en andere exoamilasa's te hyloglucosidasen (glacoamilas).
4-amylasen die alleen glucosidische verbindingen hydrolyseren α-1,6. In deze groep zijn "de -ramificerende" enzymen en andere bekend als Pululanaas.
5-amylasen zoals α-glucosidasen, die bij voorkeur α-1,4 van korte oligosachariden worden geproduceerd door de werking van andere enzymen op substraten zoals amylose of amylopectin.
6-enzymen die het zetmeel hydrolyseren tot cyclische polymeren niet-reducers van D-glycosideverval dat bekend staat als cyclodextrina's, zoals sommige bacteriële amylasen.
Functie
Velen zijn de functies die worden toegekend aan enzymen met amylase -activiteit, niet alleen vanuit natuurlijk of fysiologisch oogpunt, maar ook vanuit commercieel en industrieel oogpunt, direct gerelateerd aan de man.
Bij dieren
Amilasa's bij dieren zijn in wezen aanwezig in speeksel, lever en alvleesklier, waar ze de afbraak bemiddelen van de verschillende polysacchariden die in het dieet worden geconsumeerd (van dierlijke oorsprong (glucogenen) of groenten (zetmeel))).
Het a-amylase aanwezig in speeksel wordt gebruikt als een indicator voor de fysiologische toestand van de speekselklieren, omdat het meer dan 40% van de eiwitproductie van deze klieren vormt.
In het mondelinge compartiment is dit enzym verantwoordelijk voor de "pre -digestie" van zetmeel, wat verspilling van maltose, maltotriosa en dextrine produceert.
Het kan u van dienst zijn: Glycosidic Link: wat is, kenmerken, typen, nomenclatuurIn planten
In planten is het zetmeel een reservepolysacharide en zijn hydrolyse, gemedieerd door amylaous enzymen, het heeft veel belangrijke functies. Onder hen kunnen ze opvallen:
- De kieming van graanzaden door de spijsvertering van de aleurona -laag.
- De afbraak van reservesubstanties voor de verwerving van energie in de vorm van ATP.
In micro -organismen
Veel micro -organismen gebruiken ililasa's om koolstof en energie te verkrijgen uit verschillende polysaccharidebronnen. In de industrie worden deze micro -organismen geëxploiteerd voor een grootschalige productie van deze enzymen, die dienen om te voldoen aan verschillende commerciële eisen van de mens.
Industrieel gebruik
In de industrie worden amylasen gebruikt met verschillende doeleinden, waaronder de vervaardiging van maltose, siropen met een hoog fructose -gehalte, mengsels van oligosachariden, dextrines, enz.
Ze worden ook gebruikt voor directe alcoholische gisting voor ethanol in de bierindustrie, en voor het gebruik van afvalwater geproduceerd tijdens plantaardige voedselverwerking als een bron van voedsel voor de groei van micro -organismen, bijvoorbeeld.
Referenties
- Aiyer, p. V. (2005). Amylasen en hun toepassingen. African Journal of Biotechnology, 4(13), 1525-1529.
- Azcón-Bieto, J., & Hiel, m. (2008). Fundamentals of Plant Physiology (2e ed.)). Madrid: McGraw-Hill Inter-American uit Spanje.
- Del vigna, p., Trinidad, een., Marine, m., SOOMEN, A., & Reis, L. (2008). Speekselsamenstelling en functies: een uitgebreide beoordeling. The Journal of Contemporary Dental Practice, 9(3), 72-80.
- Naidu, m. NAAR., & Saranraj, p. (2013). Bacteriële amylase: een overzicht. International Journal of Pharmaceutical & Biological Archives, 4(2), 274-287.
- Zout, w., & Shenker, s. (1976). Amylase- De klinische betekenis ervan: een overzicht van de literatuur. Geneesmiddel, 55(4), 269-289.
- Saranraj, p., & Stella, D. (2013). Schimmel Amylase - Een overzicht. International Journal of Microbiological Research, 4(2), 203-211.
- Solomon, E., Berg, L., & Martin, D. (1999). Biologie (5e ed.)). Philadelphia, Pennsylvania: Saunders College Publishing.
- Thoma, J. NAAR., Spradlin, J. EN., & Dygert, s. (1925). Planten- en dieramylasen. Ann. Chem., 1, 115-189.
- « Donkere veldmicroscoopkenmerken, onderdelen, functies
- Claro Field Microscope -kenmerken, onderdelen, functies »

