Koolstof Alotropen
- 1831
- 441
- Ernesto McKenzie
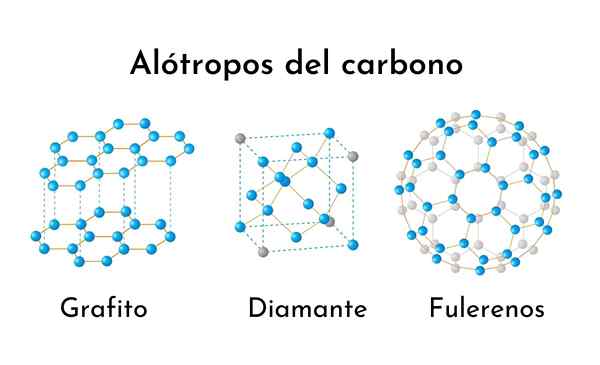
 Drie van de meest voorkomende koolstof Alotropen
Drie van de meest voorkomende koolstof Alotropen Wat zijn koolstof Alotropen?
Het alotrope woord verwijst naar de verschillende moleculaire vormen waarin een chemisch element kan worden gepresenteerd. Daarom zijn koolstofalotropen allemaal vormen, natuurlijk of niet, omdat het zuivere koolstofelement kan worden gepresenteerd.
Ondanks dat ze exact dezelfde compositie hebben, kunnen alotropen totaal verschillende eigenschappen hebben.
Dit is vooral berucht in het geval van alotropen van koolstof. Zoals we later zullen zien, vormt een van de alotropen, de diamant, perfect transparante en ongelooflijk harde kristallen, terwijl anderen zachte en brosse stoffen zijn.
Vervolgens worden alle koolstof Alotrops tot nu toe beschreven, samen met hun meest opvallende eigenschappen en hun toepassingen:
Diamant
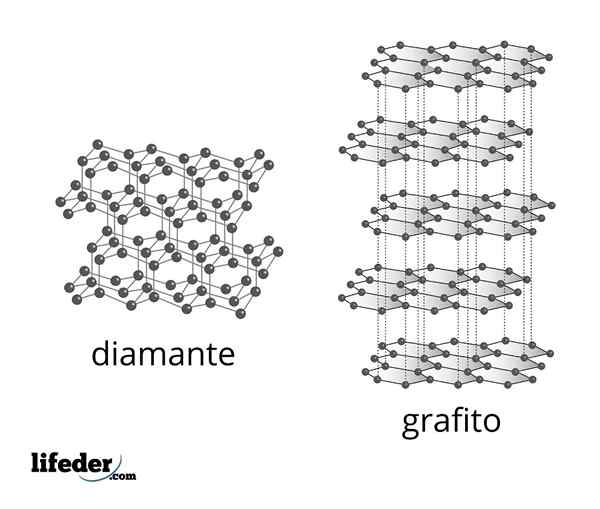 Microscopische structuur van diamant en grafiet
Microscopische structuur van diamant en grafiet De diamant is de meest stabiele vorm van koolstof en is een van de twee bekendste alotropen van dat element. Het bestaat uit tetraëdrische koolstofatomen met SP -hybridisatie3 Gekoppeld door middel van eenvoudige C-C covalente bindingen in een driedimensionaal covalent netwerk.
Deze koolstof alotroop is van nature of kan industrieel worden vervaardigd uit grafiet met hoge drukken.
Eigenschappen
- Het bestaat uit een transparante en kleurloze kristallijne vaste stof die kan worden gepolijst bij een hoge helderheid.
- Het is het moeilijkste mineraal dat door de mens bekend is. Dit betekent dat een diamant in staat is om het oppervlak van elk ander materiaal te krabben en alleen kan worden bekrast met een andere diamant.
- Het is een van de duurste natuurlijke elementen ter wereld.
- Het is de beste thermische geleider die bekend is, met een thermische geleidbaarheid tussen 1300 en 2300 w/m.K.
- Leidt geen elektriciteit.
- Het heeft een zeer lage thermische expansiecoëfficiënt.
- Het heeft een zeer lage wrijvingscoëfficiënt.
Toepassingen
- Het bekendste dagelijkse gebruik is in sieraden.
- Vanwege zijn hardheid is het een uitstekend schurende materiaal, dus het wordt toegevoegd aan het oppervlak van snij- en polijstinstrumenten van metalen, rotsen, enz.
- Vanwege zijn thermische eigenschappen wordt het gebruikt bij de vervaardiging van warmte -dissipators.
- Het wordt gebruikt bij de productie van micro -lagers met lage wrijvingen.
Grafiet
Het is weer een van de bekendste koolstof Alotropes. Het is een veel voorkomend materiaal met een structuur gevormd door vellen koolstofatomen die bovenop de andere zijn gestapeld.
Alle koolstofatomen in grafiet hebben SP -hybridisatie2, Dus ze hebben een platte trigonale structuur. Elke koolstof is gekoppeld aan drie andere aangrenzende koolstofatomen die hexagons vormen die vergelijkbaar zijn met benzeen, met een elektronensysteem PI gedemoceerd op het oppervlak van elk vel, waardoor grafiet elektriciteit wordt geleid.
Eigenschappen
- Het is een vast zwart materiaal bij kamertemperatuur.
- Het is brandstof, dus u kunt verbranden in aanwezigheid van zuurstof.
- Grafiet is een goede elektrische geleider.
- Het heeft een hoog smeltpunt.
- Het is een zacht materiaal dat de indruk wekt glad te zijn.
- Het heeft een lage wrijvingscoëfficiënt.
- Het is een goede thermische geleider.
Toepassingen
- Het wordt vaak gebruikt bij de productie van potloden om te schrijven of voor tekenen.
- Het wordt vaak gebruikt als een droog smeermiddel.
- Vanwege de elektrische geleidbaarheid en lage chemische reactiviteit wordt het vaak gebruikt in elektrische contacten in verschillende elektronische apparaten.
- Het wordt gebruikt in elektroden voor chemische analyse.
Grafeen
 Grafeenstructuur
Grafeenstructuur Grafeen is niets meer dan een vel geïsoleerd grafiet. Het wordt gedefinieerd als een twee -dimensionaal kristal en wordt verkregen door de grafietlagen te scheiden met lijmband. Grafeen heeft unieke eigenschappen die het onderscheiden van grafiet, ondanks dat ze veel in structuur lijken.
Kan je van dienst zijn: bier-lambe wetEigenschappen
- Hoge elektrische en thermische geleidbaarheid.
- Het is een elastisch en flexibel materiaal, maar tegelijkertijd met een hoge hardheid en weerstand.
- Voor het hebben van een enkele koolstofatoomdikte is het een volledig transparant materiaal.
- Het kan elektriciteit genereren door blootstelling aan zonlicht.
Toepassingen
- Flexibele schermen.
- Flexibele elektronische circuits.
- Anticorrosieve dekking.
- Zeer efficiënte zonnepanelen.
- DNA -sequentiesystemen.
- Biosensoren met hoge precisie.
Jongens of nanocarbon
De jongens zijn gesloten moleculaire structuren die alleen worden gevormd door koolstofatomen waarin regelingen worden gepresenteerd in de vorm van ringen van 4 tot 7 leden.
Afhankelijk van hun grootte en vorm worden verschillende soorten jongens meestal onderscheiden:
Buckminsterfulerane (c60))
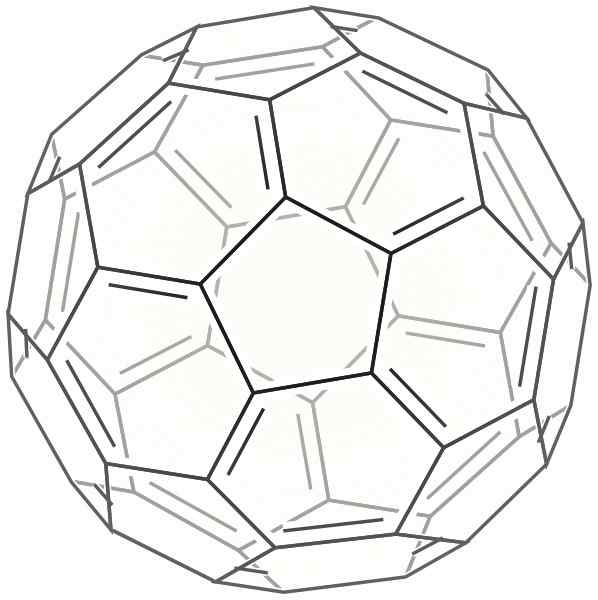 2d Buckminsterfulera skelet
2d Buckminsterfulera skelet Dit heeft de vorm van een bol die erg lijkt op een voetbal. Het wordt ook Bucky Ball genoemd.
Eigenschappen
- Hoge elektrische en thermische geleidbaarheid
- Hoge spanningsweerstand.
- Ze vormen een zeer ductiel materiaal.
- Ze zijn relatief inert op chemische reacties.
Toepassingen
- Antivirale middelen
- Antioxidanten
- Systemen voor het toediening van geneesmiddelen
Koolstof nanobuisjes
 Structuur van een koolstof nanobuis waarin alle koolstofatomen samen worden verenigd door middel van niet -polaire covalente bindingen
Structuur van een koolstof nanobuis waarin alle koolstofatomen samen worden verenigd door middel van niet -polaire covalente bindingen Deze vormen de basis en het begin van nanotechnologie. Het zijn lange slagen met buisvormige vorm en zijn tegenwoordig een van de meest bestudeerde materialen door de talloze toepassingen van hun unieke eigenschappen.
Eigenschappen
Ze hebben dezelfde basiseigenschappen van Bucky Balls, maar wanneer ze langwerpig zijn, zijn ze betere elektriciteitsdrivers in de axiale richting.
Toepassingen
- Bij de vervaardiging van nanokomponeerde materialen met unieke mechanische, thermische en elektrische eigenschappen.
- Moleculaire elektronica -systemen.
- Biosensoren met hoge gevoeligheid.
- Energieopslagsystemen.
Grafenyleen
Deze alotrope heeft een twee -dimensionale glazen structuur die zeer lijkt op grafeen, maar gevormd door bifenileenseenheden met ringen van vier leden afgewisseld tussen de ringen van zes, in plaats van alleen zeshoekige regelingen te bevatten.
Grafiet aa '
Dit is een koolstofvorm die in 2008 is ontdekt. Het is een speciaal type grafiet dat alleen verschilt in de manier waarop de grafietbladen bovenop de andere zijn gestapeld. Het is een metastabiele grafietvorm die de vorming en eigenschappen van sommige koolstofnanobuisjes van verschillende lagen kan verklaren.
Grafenyleen
Graphenyleen is een nieuw recent ontdekte carbonotrope. Ze bestaan uit een twee -dimensionale diamantvorm die wordt verkregen door grafiet te comprimeren bij zeer hoge drukken. Dit zorgt ervoor dat grafietbladen aan elkaar zijn gekoppeld, waardoor een diamant van slechts enkele dikke koolstofatomen wordt gevormd.
Amorfe koolstof
Het bestaat meestal uit een mengsel van verschillende vormen van koolstof in verschillende verhoudingen. Nanobuisjes kunnen bevatten of andere soorten jongens, grafiet, enz. Het wordt gevonden in natuurlijke monsters zoals minerale of houtskool veroorzaakt door houtpyrolyse.
Het wordt voornamelijk gebruikt als brandstof bij verwarming, energieopwekking of voedsel koken.
Glasachtige koolstof
Het is een koolstofvorm verkregen door sommige organische voorlopers bij hoge temperaturen te verwarmen. Het is een zeer resistent materiaal bij hoge temperaturen en chemische aanval door zuur en zuurstof. Het is ook ondoordringbaar voor gassen.
- « 80 wetenschapszinnen van beroemde wetenschappers
- 100 vermoeide zinnen over leven, liefde en geluk »

