Alkynes
- 1631
- 243
- Dewey Powlowski
 Alvento -structuur, met een drievoudige link
Alvento -structuur, met een drievoudige link Wat zijn alkines?
De Alkynes Het zijn koolwaterstoffen of organische verbindingen die in hun structuren een drievoudige link tussen twee koolstofatomen presenteren. Deze drievoudige link (≡) wordt beschouwd als een functionele groep bij het vertegenwoordigen van een actieve plaats van het molecuul en is daarom verantwoordelijk voor hun reactiviteit.
Hoewel alkynes niet veel onderscheiden van alko of alkenes, vertonen ze een grotere zuurgraad en polariteit vanwege de aard van hun links. De precieze term om dit kleine verschil te beschrijven is wat bekend staat onverzadiging.
De alkanen zijn verzadigde koolwaterstoffen, terwijl de alkines het meest onverzadigd zijn ten opzichte van de oorspronkelijke structuur. Wat betekent dit? Dat een alkane h3C-CH3 (ethaan) kan dehydrogen zijn tot h2C = Ch2 (Etene) en vervolgens HC≡CH (Etino, of beter bekend als acetyleen).
Merk op dat als extra links worden gevormd tussen koolstofatomen, het aantal aan hen verbonden hydrogenen vermindert. Koolstof, vanwege de elektronische kenmerken, probeert vier eenvoudige links te vormen, dus hoe groter de neiging om te reageren (behalve voor aromatische verbindingen).
Aan de andere kant is de drievoudige link veel sterker dan de dubbele (=) of de eenvoudige (-) binding, maar tegen hoge energiekosten. Daarom kunnen de meeste koolwaterstoffen (alkans en alkenen) drievoudige bindingen vormen bij hoge temperaturen.
Als gevolg van de hoge energieën hiervan, geven ze bij het breken erg heet. Een voorbeeld van dit fenomeen is te zien wanneer acetyleen brandt met zuurstof en de intense warmte van de vlam om metalen te lassen of te smelten worden gebruikt.
Acetyleen is de eenvoudigste en meest kleine alkyn van allemaal. Andere koolwaterstoffen kunnen worden uitgedrukt uit hun chemische formule door H te vervangen door alquilicale groepen (RC≡CR '). Hetzelfde gebeurt in de wereld van organische synthese door een groot aantal reacties.
Deze alkyne treedt op door de reactie van calciumoxide van de kalksteen en de Coque, grondstof die de benodigde koolstofatomen in een elektrische oven biedt:
Cao + 3C => CAC2 + CO
De CAC2 Het is calciumcarbide, een anorganische verbinding die uiteindelijk reageert met water om acetyleen te vormen:
CAC2 + 2h2O => ca (oh)2 + HC≡CH
Fysische en chemische eigenschappen van alkines
Polariteit
De drievoudige link onderscheidt alkines van alkans en alkenes. De drie soorten koolwaterstoffen zijn apolair, onoplosbaar in water en zeer zwakke zuren. De elektronegativiteit van de dubbele en drievoudige bindingskoolvesten is echter groter dan die van eenvoudige koolstofatomen.
Volgens dit zijn koolstoffen grenzend aan drievoudige bindingsopbrengst tot inductief effect negatieve belastingsdichtheid. Om deze reden, waar zijn de C≡C- of C = C -banden er zal een grotere elektronische dichtheid zijn dan in de rest van het koolzuurhoudende skelet. Als gevolg hiervan is er een klein dipoolmoment waarbij de moleculen interageren door dipool-dipolo-krachten.
Deze interacties zijn erg zwak als hun dipoolmomenten worden vergeleken met die van het watermolecuul of alcohol. Dit wordt weerspiegeld in hun fysieke eigenschappen: alkines hebben over het algemeen hogere fusie- en kookpunten in vergelijking met die van hun minder onverzadigde koolwaterstoffen.
Kan u van dienst zijn: de 7 belangrijkste biochemie -toepassingenEvenzo zijn ze vanwege hun lage polariteit minder onoplosbaar in water, maar oplosbaar in apolaire organische oplosmiddelen, zoals benzeen.
Zuurgraad
Ook veroorzaakt deze elektronegativiteit waterstof HC≡CR is zuurder dan wie er aanwezig is in andere koolwaterstoffen. Daarom zijn alkines soorten zuurder dan alkenen en veel meer dan alkanen. De zuurgraad is echter verachtelijk in vergelijking met die van carbonzuren.
Omdat alkines zeer zwakke zuren zijn, reageren ze alleen met zeer sterke basen, zoals natrium amiduro:
HC≡CR + nanh2 => HC≡CNA + NH3
Uit deze reactie wordt een oplossing van natriumacetylure verkregen, grondstof voor de synthese van andere alkynes.
Alquinos -reactiviteit
De reactiviteit van de alkynes wordt verklaard door de toevoeging van kleine moleculen aan hun drievoudige schakel, waardoor de onverzadiging van het. Dit kunnen waterstofmoleculen, waterstofhallogeniden, water of halogenen zijn.
Hydrogenering
Het kleine H -molecuul2 Het is erg ongrijpbaar en snel, dus om de kansen te vergroten om te worden toegevoegd aan de drievoudige link van de Alkines.
Dit zijn meestal metalen (PD, PT, RH of Ni) fijn verdeeld om het oppervlak te vergroten; En op deze manier, het contact tussen waterstof en de alquino:
RC≡CR ' + 2H2 => RCH2Ch2R '
Het resultaat is dat waterstof "anker" is voor koolstofatomen die een binding breken, enzovoort totdat de overeenkomstige alkaan produceert, rCH2Ch2R '. Dit verzadigt niet alleen de initiële koolwaterstof, maar wijzigt ook de moleculaire structuur.
Toevoeging van waterstofhalogenuros
Hier wordt de anorganische molecuul HX toegevoegd, waarbij X een van de halogenen kan zijn (F, CL, BR of I):
RC≡CR ' + HX => RCH = CXR'
Hydratatie
De hydratatie van alkines is wanneer ze een watermolecuul toevoegen om een aldehyde of een keton te vormen:
RC≡CR ' + H2O => rCH2Cor '
Als r 'een h is, is het een aldehyde; Als het een huur is, dan is het een cetona. In de reactie wordt een verbinding bekend als enol (rCH = c (oh) r ') gevormd als een tussenpersoon.
Dit lijdt een conversie van de enolische vorm (C-OH) naar keton (C = O) in een balans genaamd tautomerisatie.
Toevoeging van halogenen
En met betrekking tot toevoegingen kunnen de diatomee -moleculen van halogenen ook worden verankerd aan koolstoffen (x x2= F2, Klet2, BR2 ik vernam2):
RC≡CR ' + 2x2 => Rcx2-CX2R '
Acetyleenalkylering
Uit de natriumacetylure -oplossing kunnen andere alkines worden bereid met behulp van een huurhalogenide:
HC≡CNA + RX => HC≡CR + NAX
Als het bijvoorbeeld het methyljodide was, dan zou de resulterende alkyne zijn:
HC≡CNA + CH3I => HC≡CCH3 + Nax
HC≡CCH3 is de juiste, ook bekend als Methylacetyleen.
Chemische structuur van alkines
 Chemische structuur van de alquino
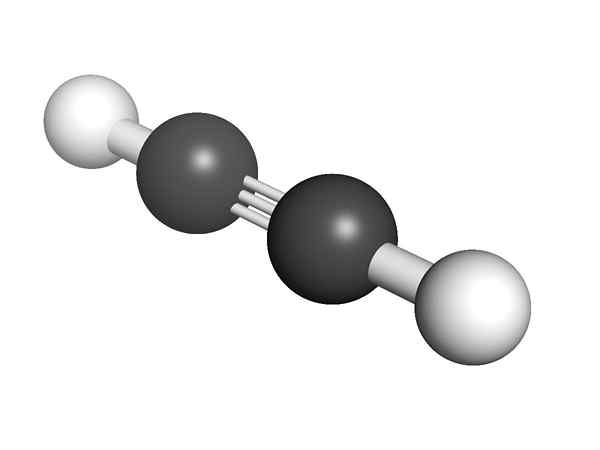
Chemische structuur van de alquino Wat is de structuur van de alkynes? In het bovenste beeld wordt een acetyleenmolecuul getoond. De lineaire geometrie van de C≡C -link kan er duidelijk uit zijn.
Daarom, waar een drievoudige binding is, moet de structuur van het molecuul lineair zijn. Dit is weer een van de opmerkelijke verschillen tussen hen en de rest van de koolwaterstoffen.
Het kan u van dienst zijn: cycopropaan (C3H6)De alkanen worden meestal weergegeven als zigzags, omdat ze spybridisatie hebben3 en hun links zijn gescheiden 109º. Ze zijn eigenlijk een covalent verenigde tetrahedra -keten. Terwijl alkenen plat zijn voor SP -hybridisatie2 van zijn koolstofatomen, die meer specifiek een trigonaal vlak vormen met gescheiden schakels door 120º.
In alkynes is orbitale hybridisatie SP, dat wil zeggen dat ze 50% van een en 50% van een p hebben. Er zijn twee SP -hybride orbitalen die zijn gekoppeld aan H -atomen in acetyleen- of alkyne -groepen in de alkines.
De afstand zowel H als R is 180º, naast het feit dat alleen op deze manier de pure koolstofatomen orbitalen de drievoudige binding kunnen vormen. Om deze reden is de link -c≡C- lineair. Het zien van de structuur van elk molecuul de -C≡C- hoogtepunten in die gebieden waar het skelet erg lineair is.
Afstand van de links en terminale aalmoes
Koolvesten in de drievoudige binding zijn op een kleinere afstand dan in het dubbele of de eenvoudige link. Met andere woorden, C≡C is korter dan C = C en die C-C. Als gevolg hiervan is de link sterker omdat de twee π -links bijdragen om de eenvoudige link σ te stabiliseren.
Als de drievoudige binding zich aan het einde van een ketting bevindt, dan is het een terminal alkyne. Daarom moet de formule van genoemde verbinding HC≡CR zijn, waarbij de H het einde of het begin van de ketting opmerkt.
Als het daarentegen een drievoudige interne link is, is de formule RC≡CR ', waarbij r en r' de rechter- en linkerkant van de ketting zijn.
Nomenclatuur van de Alquinos
Hoe worden alkines aangesteld volgens de regels die zijn bepaald door de IUPAC? Op dezelfde manier als de Alquenos en Alkenes zijn benoemd. Om dit te doen is het achtervoegsel -ano of -eno voor het achtervoegsel -ino gewijzigd.
Bijvoorbeeld: HC≡CCH3 Het is benoemd tot tips, omdat het drie koolstofatomen heeft, zoals propaan (Cho3Ch2Ch3)). De HC vergelijk2Ch3 Het is de 1-butino, een terminale alkyn. Maar in het geval van Cho3C≡CCH3 Dit is de 2-butino, en hierin is de drievoudige link niet terminaal maar intern.
De ch3C≡CCH2Ch2(Ch3))2 Het is 5-methyl-2-hexine. Koolstofatomen begint vanaf de zijkant die het dichtst bij de drievoudige link ligt.
Een ander type alkines zijn de cycloalquins. Voor hen is het voldoende om het achtervoegsel -Ano door -ino van de overeenkomstige cycloalcan te vervangen. Aldus wordt het cyclopropaan met een drievoudige binding genoemd als cyclopropine (die niet bestaat).
Wanneer er twee drievoudige links zijn, wordt het voorvoegsel DI aan de naam toegevoegd-. Het heeft als voorbeelden van HC≡C-C Cent, diacetyleen of propadine; En naar HC≡C-C-C Cotel, Butadiino.
Alquinos gebruikt
Acetyleen of Etino
De kleinste van de alkynes dikker het mogelijke aantal gebruik voor deze koolwaterstoffen. Van het tot en met alks kunnen andere organische verbindingen worden gesynthetiseerd. Het ondergaat ook oxidatieve reacties om onder andere ethanol, azijnzuur, acrylzuur te verkrijgen.
Kan u van dienst zijn: lithiumhydride: structuur, eigenschappen, verkrijgen, gebruikAndere van het gebruik ervan bestaat uit het leveren van de warmtebron om de elektronen van atomen op te wekken; Meer specifiek, E van metaalkationen in bepalingen door atoomabsorptie-emissie, veel gebruikte spectroscopische techniek.
Natuurlijke alkines
De enige bestaande methoden om alkynes te bereiden zijn niet alleen synthetisch of met warmte -toepassing in afwezigheid van zuurstof, maar ook biologisch.
In deze enzymen genoemd Acetylese, die een dubbele binding kan ontkennen. Dankzij dit worden veel natuurlijke bronnen van alkynes bereikt.
Hierna kunnen deze bronnen worden geëxtraheerd vergiften, antidotes, medicijnen of een andere verbinding die enig voordeel biedt; vooral als het de gezondheid betreft. De alternatieven zijn veel bij het wijzigen van hun oorspronkelijke structuren en ze als ondersteuning voor nieuwe alkines hebben.
Voorbeelden van alkynes
Tot nu toe zijn er talloze voorbeelden van alkines genoemd. Sommigen komen echter uit zeer specifieke bronnen of hebben bepaalde moleculaire structuren: ze zijn polyacetyle.
Dit betekent dat er mogelijk meer dan een drievoudige schakel is die deel uitmaakt van een zeer grote structuur, en niet alleen van een eenvoudige koolzuurhoudende keten.
Taririnezuur
 Taryrinezuurstructuur
Taryrinezuurstructuur Taririnezuur komt van een plant in Guatemala genaamd Picramnia tariri. Het wordt specifiek uit de olie uit zijn zaden geëxtraheerd.
In zijn moleculaire structuur kan een enkele drievoudige link worden waargenomen die een apolaire staart scheidt van een polaire kop; Daarom kan het worden beschouwd als een amfipatisch molecuul.
Histrionicotoxine
 Histrionicotoxinestructuur
Histrionicotoxinestructuur Histrionicotoxine is een gif gescheiden door de huid van inwoners van Colombia, Brazilië en andere Latijns -Amerikaanse landen. Het heeft twee drievoudige geconjugeerde links met een dubbele binding. Beide zijn terminals en worden gescheiden door een zes -koolstofring en een cyclische amine.
Cicutoxine
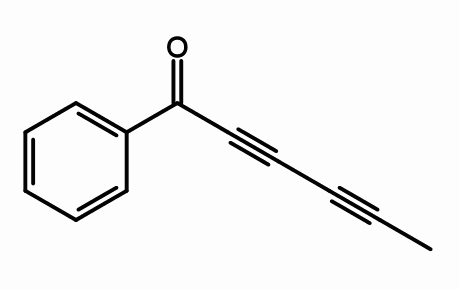 Cicutoxinestructuur. Door Giorgiogp2 [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0) of gfdl (http: // www.GNU.Org/copyleft/fdl.html)], van Wikimedia Commons
Cicutoxinestructuur. Door Giorgiogp2 [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0) of gfdl (http: // www.GNU.Org/copyleft/fdl.html)], van Wikimedia Commons Van de moleculaire structuur van cicutoxine, waar zijn de drievoudige links? Als de dubbele bindingen plat zijn, zoals ze goed worden gezien, en de eenvoudige bindingen zijn tetraëderalen, zoals aan de uiteinden, zijn de triples lineair en staan ze op de helling (\).
Deze verbinding bestaat uit een neurotoxine voornamelijk gevonden in de aquatische genezingsinstallatie.
Capillina
 Capillina structuur. Door Klever [CC0], van Wikimedia Commons
Capillina structuur. Door Klever [CC0], van Wikimedia Commons Het is een alkyne aanwezig in de etherische olie van Artemis -planten die wordt gebruikt als een antischimmelmiddel. Twee drievoudige opeenvolgende links kunnen worden waargenomen, correcter geconjugeerd.
Wat betekent het? Dat de drievoudige bindingen resoneren langs de gehele koolstofketen en omvat dat de dubbele binding c = o wordt geopend voor C-O-.
Pargiline
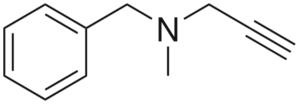 Structuur van pargiline
Structuur van pargiline Het is een alty met antihypertensieve activiteit. Het analyseren van de structuur in delen is: een benchilo -groep links, een tertiair amine in het midden en een rechter -wing; dat wil zeggen een terminalseigenschapsgroep.
Referenties
- Francis a. Schildpad. Organische chemie. Carbonzuren. (zesde editie., Pagina 368-397). MC Graw Hill.
- Brennan, John. (10 maart 2018). Voorbeeld van alkynes. Wetenschap. Uitgebracht van: wetenschappelijk.com
- Byju's. (2018). Triple Bond in Alkynes. Genomen uit: byjus.com
- Encyclopedia of Voorbeelden (2017). Alkynes. Hersteld van: voorbeelden.co
- Kevin A. Boudaux. Alkynes. Genomen van: Angelo.Edu
- Robert C. Neuman, jr. Alkenes en alkynes. [PDF]. Genomen uit: chem.UCR.Edu

