Alkenes
- 3442
- 160
- Cecil Graham
 Alkenen of olefines zijn onverzadigde koolwaterstoffen die ten minste een dubbele koolstof-koolstofbinding in hun structuur hebben
Alkenen of olefines zijn onverzadigde koolwaterstoffen die ten minste een dubbele koolstof-koolstofbinding in hun structuur hebben Wat zijn alkenes?
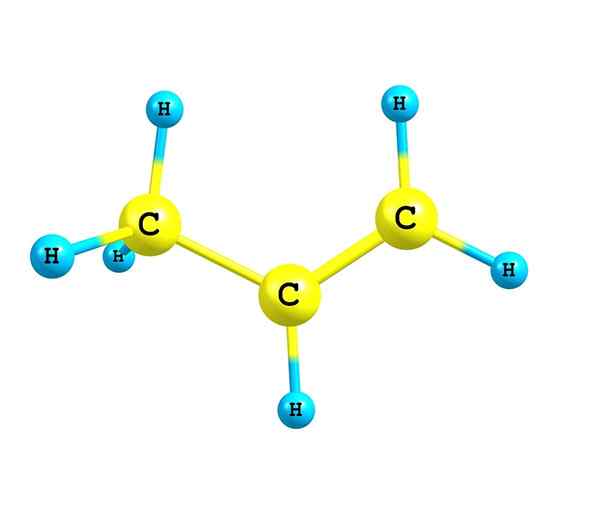
De alkenen of olefines Het zijn onverzadigde koolwaterstoffen die op zijn minst een dubbele binding in hun structuur hebben. Ze worden olefines genoemd vanwege het vermogen van het eteen of ethyleen om te reageren met halogenen om olie of olie te produceren. Momenteel is de term Olefinas niet gebruikt en deze verbindingen worden nu alkenes genoemd.
De fysische eigenschappen van alkenen worden beïnvloed door hun molecuulgewicht, evenals hun koolzuurhoudende skelet. Alkenen met 2 tot 4 koolstofatomen (Buteno Etene) zijn bijvoorbeeld gassen. Met 5 tot 18 koolstofatomen in de lange keten zijn vloeistof. Terwijl alkenen met meer dan 18 koolstofatomen vast zijn.
De aanwezigheid van dubbele binding biedt grote reactiviteit, waardoor veel chemische reacties worden ervaren, zoals toevoeging, eliminatie, hydrogenering, hydratatie en polymerisatie, waardoor het talloze toepassingen en toepassingen kan genereren.
Alkenen worden industrieel geproduceerd door het thermische kraken van een hoog molecuulgewicht (paraffine wassen); Katalytische dehydrogenering en chlorering-dehydroclokloinatie.
Chemische structuur van alkenen
 Bron: zelf gemaakt
Bron: zelf gemaakt Alkenen worden gekenmerkt door een of meer dubbele links in hun structuur te hebben. Dit wordt weergegeven als C = C, met beide koolstofatomen een SP -hybridisatie2.
Daarom is het kettinggebied waar dubbele binding is, of onverzadiging, plat is. Het is ook een meritor om erop te wijzen dat de twee koolstofatomen kunnen worden gekoppeld aan twee andere substituenten (of groepen).
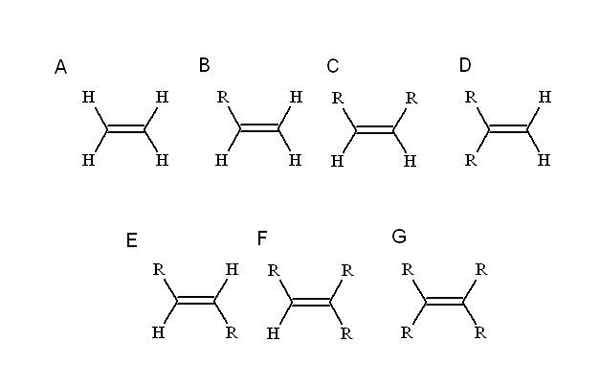
Welke substituenten? Iedereen die een van de eenvoudigste alkeen's hydrogenen vervangt: ethyleen (of Eteno). Beginnend met hem (A, Superior Image) R, een alquilisch substituent, neemt de plaats in van een van de vier hydrogenen om een mono-substitute alkeen te veroorzaken (B).
Tot nu toe, ongeacht welke waterstof wordt vervangen, is de identiteit van B niet gewijzigd. Dit betekent dat het stereoisomeren mist, samengesteld met gelijke chemische formules, maar met een andere ruimtelijke dispositie van zijn atomen.
Kan u van dienst zijn: gelijkwaardigheidspuntStereoisomeren
Wanneer een tweede waterstof wordt vervangen door een andere R, zoals in C, nu de stereoisomeren C, D en E. Dit komt omdat ruimtelijke oriëntaties met betrekking tot zowel R kunnen variëren, en om elkaar te onderscheiden, cis-trans- of e-Z-toewijzingen worden gebruikt.
In C, di-substitute alkeen kunnen de twee r kettingen zijn van elke lengte of een paar heteroátomo. De ene staat in frontale positie in relatie tot de andere. Als de twee r bestaan uit dezelfde substituent, bijvoorbeeld f, dan is C de stereoisomeer-cis.
In D zijn beide R -groepen nog dichterbij, omdat ze gekoppeld zijn aan hetzelfde koolstofatoom. Dit is de Geminale stereoisomeer, hoewel meer dan een stereoisomeer, het eigenlijk een terminale dubbele binding is, dat wil zeggen dat het aan het einde of principe van een keten is (om die reden heeft het twee hydrogenen de andere koolstof).
En in E, de meest stabiele stereoisomeren (of geometrische isomeren), worden de twee R -groepen gescheiden door een grotere afstand, die de diagonaal van de dubbele binding kruist. Waarom is het meest stabiel? Het is omdat omdat de ruimtelijke scheiding tussen hen groter is, dus er is geen zusterspanning tussen de twee.
Aan de andere kant zijn F en G respectievelijk tri- en tetra-toegevoegde alkenen. Nogmaals, ze kunnen geen stereoisomeer genereren.
Fysische en chemische eigenschappen van alkenen
Oplosbaarheid
Ze zijn niet -mengbaar met water vanwege hun lage polariteit. Maar ze lossen op in organische oplosmiddelen.
Fusiepunten op ºC
Etano -169, propeno -185, 1 -pentijn -165, 1 -Hepteno -119, 3 -Octein
-101.9, 3 -None -81.4 en 5 -dechenum -66,3.
Kookpunt in º C
Etano -104, propeno -47, trans2buteno 0.9, cis2buteno 3,7, 1-penteen 30, 1-hepteno 115, 3-oK 122, 3-noneno 147 en 5-decept.
Kan u van dienst zijn: laboratoriumfilter): kenmerken, functies, typenHet kookpunt neemt toe in directe relatie tot het aantal alkene -koolstofatomen. Aan de andere kant, hoe meer vertakt zijn structuur, hoe zwakst zijn intermoleculaire interacties, die worden weerspiegeld in de afname van het koken of fusiepunt.
Dikte
Etano 0,6128 mg/ml, propeno 0,6142 mg/ml en 1-buteen 0,6356 mg/ml, 1-pente 0,64 mg/ml en 1-hexen 0,673.
In alkenen is de maximale dichtheid 0,80 mg/ml. Dat wil zeggen, ze zijn minder dicht dan water.
Polariteit
Het hangt af van de chemische structuur, substituties en aanwezigheid van andere functionele groepen. De alkenen hebben een dipmers, dus het 2-Buteen CIS-isomeer.
Alkenenreactiviteit
Alkenen hebben een grote capaciteit om te reageren vanwege de dubbele links die ze hebben. Onder de betrokken reacties zijn: toevoeging, eliminatie, vervanging, hydrogenering, hydratatie en polymerisatie.
Toevoegingsreactie
H2C = Ch2 + Klet2 => Clch2-CCLH2 (ethyleen dichloride)
Hydrogeneringsreactie
Het komt voor bij hoge temperaturen en in aanwezigheid van adequate katalysatoren (PT, PD of fijn verdeeld)
Ch2= Ch2 + H2 => Ch3-Ch3 (Etano)
Hydratatiereactie
Reactie die de bron van alcoholgeneratie is uit oliedederivaten:
H2C = Ch2 + H2O => H3C-CH2Oh (ethylalcohol)
Polymerisatiereacties
Ethyleen in aanwezigheid van katalysatoren zoals aluminium proefquil en titaniumtetrachloride polymeriza in polyethyleen, dat ongeveer 800 koolstofatomen bevat. Dit type polymeer wordt het toevoegingspolymeer genoemd.
Gebruik en toepassingen van alkenen
Polymeren
- Polyethyleen met lage dichtheid wordt gebruikt bij de vervaardiging van zakken, broeikasplastics, verpakking, gerechten, schepen, enz. Hoewel de hoge dichtheid rigide en mechanisch bestandder is, met behulp van de vervaardiging van dozen, meubels, beschermers zoals helmen en knieën, speelgoed en pallets.
- Polypropyleen, propyleen polymeer, wordt gebruikt bij de uitwerking van containers, vellen, laboratoriumapparatuur, speelgoed, verpakkingsfilms, sogasfilamenten, stoffering en tapijten.
- Polyvinylchloride (PVC) is een polymeer van vinylchloride dat wordt gebruikt bij de productie van buizen, tegels voor vloeren, kanalen, deuren en ramenframes, enz.
- Polybutadieen, polymeer van 1,3-butadieen, is bedoeld voor de productie van lagerbanden, slangen en voertuigbanden, evenals voor de coating van metalen blikjes.
- Ethyleen- en propyleencopolymeren worden gebruikt bij de productie van slangen, lichaam en delen van het chassis voor textiel, enz.
Alkenes
- Ze worden gebruikt bij het verkrijgen van oplosmiddelen zoals ethyleenglycol en dioxaan. Ethyleenglycol wordt gebruikt als antivries in autoradiatoren.
- Ethyleen is een hormoon van planten dat de groei, zaadkieming en de ontwikkeling van fruit regelt. Daarom wordt het gebruikt om de rijping van bananen te veroorzaken wanneer ze hun bestemming bereiken.
- Ze worden gebruikt als grondstof voor de productie van vele verbindingen zoals alkylhalogeniden, ethyleenoxide en vooral ethanol. Ze hebben ook gebruik in de industrie, persoonlijke verzorging en medicijnen.
- Ze worden gebruikt bij het verkrijgen en produceren van lakken, wasmiddelen, aldehyden en brandstoffen. 1.3-butadieno wordt gebruikt als grondstof bij de productie van synthetische rubbers.
Referenties
- Chemie -toewijzing. Fysieke eigenschappen van alkenen. Uitgevoerd uit: chemie-toewijzing.com
- Wikipedia. (2018). Alkene. Genomen van: in.Wikipedia.borg
- Chemistry Libhethexts. Fysieke eigenschappen van alkenen. Genomen uit: chem.Librhetxts.borg
- Whitten, Davis, Peck & Stanley. Scheikunde. (8e ed.)). Cengage leren.
- Francis a. Schildpad. Organische chemie. (Zesde editie., Pagina 194). MC Graw Hill.
- Houchton Mifflin Harcourt. (2016). Alkenen: moleculaire en structurele formules. Uitgevoerd uit: Cliffsnotes.com
- Chipera, Angie. (25 april 2017). Wat is een olefin in chemie? Wetenschap. Uitgebracht van: wetenschappelijk.com

