Alosterisme algemene aspecten, functies en voorbeelden

- 3992
- 1082
- Glen Armstrong
Hij Alosterisme o Alostrische regulatie wordt gedefinieerd als het proces van remming of activering van een enzym gemedieerd door een regulerend molecuul anders dan zijn substraat en werkt op een specifieke plaats van zijn structuur, anders dan de actieve plaats van hetzelfde.
De term "Alosterisch" of "Alosterism" komt van de Griekse wortels "Allos ", wat "een ander" betekent en "Stereós", wat "vorm" of "plaats" betekent; Dus vertaalt zich letterlijk als "andere ruimte", "een andere plaats" of "een andere structuur".
 Grafisch schema van A tot theosterische regelgeving. (A) Actieve site. (B) Alosterische site. (C) Substraat. (D) remmer. (E) Enzym. (Bron: Isaac Webb [CC BY-S (https: // creativeCommons.Org/licenties/by-sa/3.0)] via Wikimedia Commons)
Grafisch schema van A tot theosterische regelgeving. (A) Actieve site. (B) Alosterische site. (C) Substraat. (D) remmer. (E) Enzym. (Bron: Isaac Webb [CC BY-S (https: // creativeCommons.Org/licenties/by-sa/3.0)] via Wikimedia Commons) Sommige auteurs beschrijven alosterisme als een proces waarbij externe sites in een systeem (bijvoorbeeld de structuur van een enzym) energetisch gekoppeld zijn om een functionele respons te produceren, daarom kan worden aangenomen dat een verandering in een regio een andere kan beïnvloeden elke andere in hetzelfde.
Dit type regulatie is typerend voor de enzymen die deelnemen aan meerdere bekende biologische processen, zoals signaaltransductie, metabolisme (anabolisme en katabolisme), de regulatie van genetische expressie, onder anderen.
De eerste ideeën over alosterisme en hun deelname aan de controle van cellulair metabolisme werden in de jaren zestig gepostuleerd door F. Monod, f. Jacob en J. Veranderendeux, tijdens het bestuderen van de biosynthetische routes van verschillende aminozuren, die werden geremd na de accumulatie van de eindproducten.
Hoewel de eerste publicatie in dit opzicht te maken had met genetische regulatie, breidden een korte tijd later Monod, Wyman en Changeux de conceptie van alosterisme uit tot eiwitten met enzymatische activiteit en stelde een model voor op basis van multimere eiwitten, voornamelijk ondersteund door interacties tussen subeenheden wanneer een Hiervan zijn lid geworden van een effector.
Kan u van dienst zijn: Guanina: kenmerken, structuur, training en functiesVeel van de volgende concepten hadden hun basis in de theorie van "geïnduceerde aanpassing" die een paar jaar eerder door Koshland werd geïntroduceerd.
[TOC]
Algemene functies
Over het algemeen hebben alle enzymen twee verschillende locaties voor Ligand Union: de ene staat bekend als de actieve site, die zich bij de moleculen verbindt die functioneren als een substraat (verantwoordelijk voor de biologische activiteit van het enzym), en de andere is de andere bekend als theosterisch site, die specifiek is voor andere metabolieten.
Deze "andere metabolieten" worden alesthere effectoren genoemd en kunnen positieve of negatieve effecten hebben op de snelheid van reacties die worden gekatalyseerd door enzymen of in de affiniteit waarmee ze zich bij hun substraten voegen in de actieve site.
Meestal heeft de unie van een effector op de AL, een enzymlocatie, een effect op een andere plaats van de structuur, waardoor de activiteit of functionele prestaties worden gewijzigd.
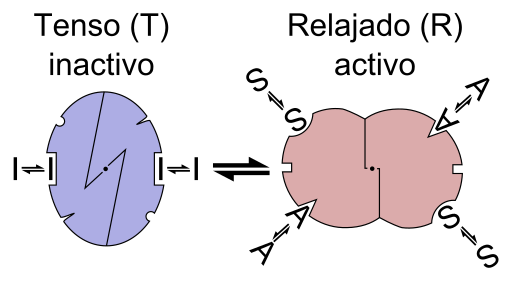 Grafisch schema van de reactie van een enzym alosterica (Bron: Bestand: Enzym Allostery is.PNG: Bestand: Enzym Allostery.PNG: Allostery.PNG: Nicolas Le Novere (Talk).Lenov bij in.Wikipediaderivative Work: Timvickers (Talk) Derivatief Werk: Retama (Talk) Derivatief Werk: KES47 [CC BY-SA (https: // CreativeCommons.Org/licenties/by-sa/3.0) Via Wikimedia Commons)
Grafisch schema van de reactie van een enzym alosterica (Bron: Bestand: Enzym Allostery is.PNG: Bestand: Enzym Allostery.PNG: Allostery.PNG: Nicolas Le Novere (Talk).Lenov bij in.Wikipediaderivative Work: Timvickers (Talk) Derivatief Werk: Retama (Talk) Derivatief Werk: KES47 [CC BY-SA (https: // CreativeCommons.Org/licenties/by-sa/3.0) Via Wikimedia Commons) Met andere woorden, de vereniging van een alestro -effector voor zijn specifieke plaats in de structuur van een enzym veroorzaakt een verandering in de moleculaire geometrie van het enzym, dat bekend staat als de overgang naar theosterisch, dat wil zeggen een gebeurtenis die wordt overgedragen die wordt overgedragen In het hele macromolecuul is het aanpassing van het gedrag.
Alosterisme kan homotropisch of heterotrope zijn. Een homotrope alostroïcregulatieproces wordt gedefinieerd als het dat hetzelfde substraat van een enzym fungeert als zijn alestrische regulator, dat wil zeggen dat de alosterische effector hetzelfde substraat is; Het is ook bekend als een type coöperatie.
Een heterotrope regulatieproces daarentegen verwijst naar de regulatie van de activiteit van een enzym gemedieerd door een molecuul of effector van theoster die verschilt van zijn substraat, en kan ook positieve of negatieve effecten hebben op de activiteit van de enzyme.
Het kan u van dienst zijn: APTENIA CORDIFOLIA: Kenmerken, habitat, eigenschappen, teeltFunctie
Alosterisme, samen met de regulatie van genetische expressie, translatie en eiwitafbraak, is een van de fundamentele mechanismen voor de regulatie van een groot aantal organische processen, die essentieel is voor het behoud van homeostase en voor het overleven van alle levende, eencellige of multicellulaire wezens.
De toostale regulatie of alosterisme geeft levende organismen het vermogen om te reageren met grote gevoeligheid voor veranderingen in de concentratie van regulerende liganden, evenals die van oorspronkelijke ritmische fenomenen op cellulair niveau.
Aangezien energie- en metabole substraten eindig zijn in een cel, staat alosterisme op het metabolische veld het matige gebruik van middelen toe, waardoor zowel nutteloze cycli als de verspilling van energie worden vermeden voor de overmatige verwerking van substraten in overvloed aan overvloed of van tekort.
Evenzo is dit regulatiemechanisme van groot belang voor celsignaleringsprocessen, waarbij veel conformationele veranderingen die worden veroorzaakt door de vereniging van verschillende liganden op specifieke locaties van de betreffende receptoren betrokken.
Voorbeelden van Aosterisme
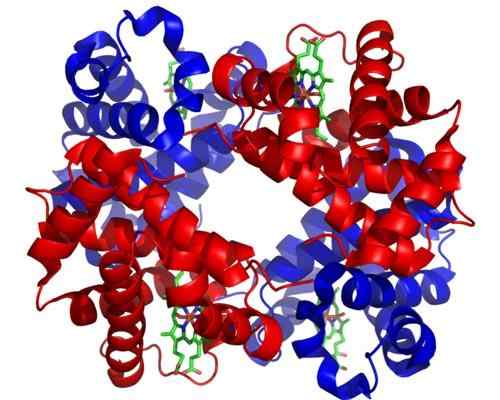 Hemoglobine. Genomen en bewerkt uit: Zephyris bij de Engelse taal Wikipedia [CC BY-SA 3.0 (http: // creativeCommons.Org/licenties/by-sa/3.0/]].
Hemoglobine. Genomen en bewerkt uit: Zephyris bij de Engelse taal Wikipedia [CC BY-SA 3.0 (http: // creativeCommons.Org/licenties/by-sa/3.0/]]. Hoewel er duizenden voorbeelden zijn van het toosterisme of de regulering in de natuur, zijn sommige prominenter geweest dan andere. Dat is het geval van hemoglobine, dat een van de eerste eiwitten was die in het structurele aspect diepgaand beschreven,.
Hemoglobine is voor veel dieren een zeer belangrijk eiwit, omdat het verantwoordelijk is voor het transport van zuurstof door het bloed van de longen naar de weefsels. Dit eiwit presenteert tegelijk.
Kan u van dienst zijn: Saltacionisme: kenmerken, bewijs en voorbeeldenHomotrope alosterisme van hemoglobine heeft te maken met de vereniging van een zuurstofmolecuul voor een van de subeenheden die het samenstellen, beïnvloedt direct de affiniteit waarmee de subeenheid grenzend aan een ander zuurstofmolecuul bindt, waardoor deze wordt verhoogd (positieve of coöperativisme -regulatie).
Heterotropisch tot de heterotrope
Heterotrope alosterisme daarentegen is gerelateerd aan de effecten van zowel de pH als de aanwezigheid van 2,3-diffoglyceraat op de unie van zuurstof aan de subeenheden van dit enzym, die het remmen.
Transcarbamilase of Atcasa aspartaat, dat deelneemt aan de pyrimidinesyntheseroute, is ook een van de "klassieke" voorbeelden van alosterische regulatie. Dit enzym, dat 12 subeenheden heeft, waarvan 6 katalytisch actief zijn en 6 regulatoren zijn, wordt heterotropisch geremd door het eindproduct van de route die kopt, het cytidininatrifosfaat (CTP).
Lactose -operon EN. coli
De vrucht van de eerste ideeën van Monod, Jacob en Changeaux was een artikel gepubliceerd door Jacob en Monod gerelateerd aan de lactose van de lactose van de lactose van Escherichia coliJe, dat is een van de typische heterotrope tot genetische reguleringsvoorbeelden.
De toostale regulatie van dit systeem is niet gerelateerd aan het vermogen om een substraat om te zetten in een product, maar met de affiniteit van de unie van een eiwit naar het operationele DNA -gebied.
Referenties
- Changeux, J. P., & Edelstein, s. J. (2005). Allosterische mechanismen van signaaltransductie. Science, 308 (5727), 1424-1428.
- Goldbeter, a., & Dupont, G. (1990). Allosterische regulatie, samenwerking en biochemische oscillaties. Biophysical Chemistry, 37 (1-3), 341-353.
- Jiao, W., & Parker, en. J. (2012). Een compinatie van computationele en experimentele technieken gebruiken om de moleculaire basis voor eiwitallosterie te begrijpen. In Advances in Protein Chemistry and Structural Biology (Vol. 87, pp. 391-413). Academische pers.
- Kern, D., & ZUIDERWEG, en. R. (2003). De rol van dynamiek in allosterische regulering. Huidige mening in structurele biologie, 13 (6), 748-757.
- Laskowski, r. NAAR., Gerick, f., & Thornton, J. M. (2009). De structurele basis van allosterische regulatie in eiwitten. FEBS Letters, 583 (11), 1692-1698.
- Mathews, c. K., Van Holde, K. EN., & Ahern, k. G. (2000). Biochemistry, ed. San Francisco, Californië.
- « Koolstof nanobuisjes structuur, eigenschappen, toepassingen, toxiciteit
- Adaptief stralingsproces, typen en voorbeelden »

