Tertiaire alcoholstructuur, eigenschappen, voorbeelden
- 1843
- 139
- Dr. Rickey Hudson
A Tertiaire alcohol Het is er een waarin de hydroxylgroep, OH, is gekoppeld aan een tertiaire koolstof. De formule blijft ROH, net als andere alcoholen; Maar het wordt gemakkelijk herkend omdat OH dicht bij een X in de moleculaire structuur staat. Ook is de koolzuurhoudende ketting meestal korter en de belangrijkste moleculaire massa.
Dan is een tertiaire alcohol meestal zwaarder, het is meer vertakt en het is ook het minst reactief met betrekking tot oxidatie; dat wil zeggen, het kan niet worden getransformeerd in een ceton of carbonzuur, zoals respectievelijk met secundaire en primaire alcoholen.
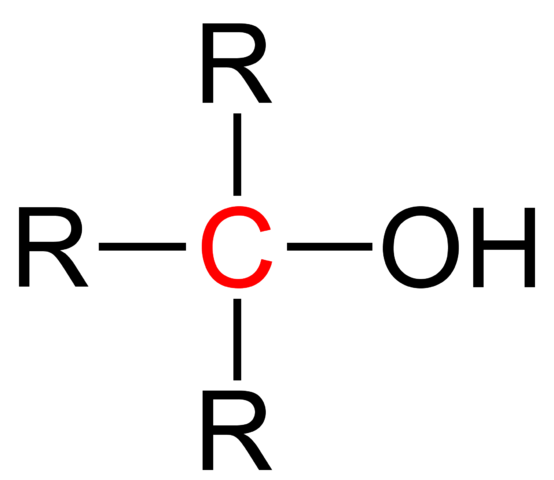
 Structurele formule van een tertiaire alcohol. Bron: Jü [Public Domain].
Structurele formule van een tertiaire alcohol. Bron: Jü [Public Domain]. De algemene structurele formule voor een tertiaire alcohol wordt weergegeven in het bovenste beeld. Volgens haar zou een nieuwe R -type formule kunnen worden geschreven3Coh, waar r een alkyl- of arylgroep kan zijn; Een methil -groep, ch3, of een korte of lange koolzuurhoudende ketting.
Als de drie R -groepen verschillen, zal de centrale koolstof van tertiaire alcohol chiraal zijn; dat wil zeggen, alcohol zal optische activiteit vertonen. Voor dit feit brengen de tertiaire quirale alcoholen interesse in de farmaceutische industrie, omdat van ketonen met biologische activiteit deze alcoholen worden gesynthetiseerd met complexere structuren.
[TOC]
Structuur van een tertiaire alcohol
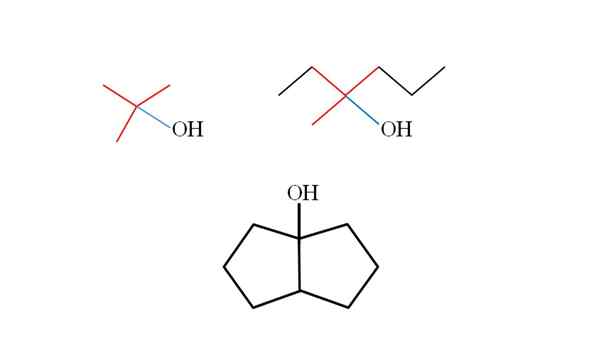 Drie tertiaire alcoholen en hun structuren. Bron: Gabriel Bolívar.
Drie tertiaire alcoholen en hun structuren. Bron: Gabriel Bolívar. Overweeg de structuren van de bovenste tertiaire alcoholen om ze te leren herkennen, ongeacht de verbinding. De koolstof gekoppeld aan OH moet ook worden gekoppeld aan drie andere koolstofatomen. Als het in detail wordt waargenomen, voldoen de drie alcoholen hieraan aan.
De eerste alcohol (links), bestaat uit drie groepen CH3 Centrale koolstof gekoppeld, wiens formule zou zijn (cho3))3Coh. De huurgroep (kies3))3C- Het staat bekend als tertbutil.
Het kan u van dienst zijn: potentiometer (phameter)De tweede alcohol (aan de rechterkant) heeft de centrale koolstoflin3, Ch3Ch2 en ch2Ch2Ch3. Omdat de drie groepen verschillen, is alcohol chirale en vertoont daarom optische activiteit. Een T wordt hier niet waargenomen, maar een X dicht bij OH (rood en blauw).
En in de derde alcohol (de onderstaande en zonder kleuren) is de OH gekoppeld aan een van de twee koolstofatomen die zich bij twee cyclopentano aansluiten. Deze alcohol vertoont geen optische activiteit omdat twee van de centrale koolstofgekoppelde groepen identiek zijn. Net als de tweede alcohol, als deze zorgvuldig wordt waargenomen, zal ook een X (eerder een tetraëder) worden gevonden.
Sterische hinder
De drie superieure alcoholen hebben iets meer gemeen dan een X: centrale koolstof wordt sterisch voorkomen; dat wil zeggen, er zijn veel atomen om hem heen in de ruimte. Een onmiddellijk gevolg hiervan is dat nucleofielen, enthousiast naar positieve ladingen, moeilijkheden krijgen om deze koolstof te benaderen.
Aan de andere kant, met drie koolstof gekoppeld aan de centrale koolstof, doneren ze een deel van de elektronische dichtheid dat het elektronegatieve zuurstofatoom het aftrekt en het nog meer stabiliseert voor deze nucleofiele aanvallen. Tertiaire alcohol kan echter vervangen door carbocatie te vormen.
Eigenschappen
Fysiek
De 3e alcoholen presenteren over het algemeen sterk vertakte structuren. Een eerste gevolg hiervan is dat de OH -groep wordt voorkomen, en daarom heeft het dipoolmoment een klein effect op naburige moleculen.
Dit vertaalt zich in zwakkere moleculaire interacties in vergelijking met die van primaire en secundaire alcoholen.
Kan u van dienst zijn: le châtelier principeOverweeg bijvoorbeeld de structurele isomeren van butanol:
Ch3Ch2Ch2Oh (N-Butanol, PEB = 117ºC)
(Ch3))2Ch2Oh (isobutilische alcohol, PEB = 107ºC)
Ch3Ch2Ch (oh) ch3 (Secbutilic alcohol, PEB = 98ºC)
(Ch3))3Coh (tertbutilische alcohol, PEB = 82ºC)
Merk op hoe kookpunten afdalen naarmate het isomeer meer vertakt wordt.
Aanvankelijk werd vermeld dat in de structuren van alcoholen 3 een X wordt waargenomen, die op zichzelf een hoge tak aangeeft. Daarom hebben deze alcoholen de neiging om lagere smelt- en/of kookpunten te hebben.
Iets vergelijkbaar is het geval voor uw mengbaarheid met water. Hoe meer voorkomen, hoe minder mengbaar oh alcohol 3 met water zal zijn. Deze mengbaarheid vermindert echter hoe langer de koolstofketen; Thermische alcohol is dus meer oplosbaar en mengbaar met water dan de N-Butanol.
Zuurgraad
Tertiaire alcoholen zijn meestal de minste zuren van allemaal. De redenen zijn talrijk en hebben betrekking op elkaar. Samenvattende rekeningen, de negatieve belasting van zijn afgeleide alcoxide, rood-, U zult een sterke afstoting voelen voor de drie alkale groepen die verband houden met de centrale koolstof, waardoor het anion wordt verzwakt.
Hoe onstabieler het anion, hoe minder de zuurgraad van alcohol zal zijn.
Reactiviteit
3e alcoholen kunnen geen oxidaties voor ketonen lijden (r2C = O) of aldehydos (RCHO) of carbonzuren (RCOOH). Enerzijds zou ik een of twee koolstofatomen moeten verliezen (in de vorm van CO2) oxideren, wat zijn reactiviteit tegen oxidatie vermindert; En aan de andere kant ontbreekt het waterstof dat kan verliezen om een andere link met zuurstof te vormen.
Het kan u van dienst zijn: pyridine: structuur, eigenschappen, gebruik, toxiciteit, syntheseZe kunnen echter vervangend en eliminatie lijden (vorming van een dubbele binding, een alkeen of olefin).
Nomenclatuur
De nomenclatuur voor deze alcoholen is niet anders dan die van anderen. Er zijn veel voorkomende of traditionele namen, en de systematische namen die zijn bestuurd door de IUPAC.
Als de hoofdketen en zijn gevolgen bestaan uit een erkende huurgroep, wordt deze gebruikt voor zijn traditionele naam; Wanneer het niet mogelijk is om dit te doen, wordt de IUPAC -nomenclatuur gebruikt.
Overweeg bijvoorbeeld de volgende tertiaire alcohol:
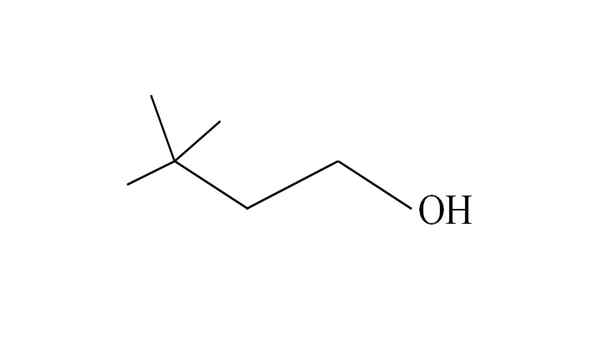 3.3-dimethyl-1-butanol. Bron: Gabriel Bolívar.
3.3-dimethyl-1-butanol. Bron: Gabriel Bolívar. Het begint koolstoffen van rechts naar links op te sommen. In de C-3 zijn er twee groepen ch3 van substituenten, en daarom is de naam van deze alcohol 3,3-dimethyl-1-butanol (de hoofdketen heeft vier koolstofatomen).
Evenzo bestaan de hele keten en de gevolgen ervan uit de Neohexilo -groep; Daarom kan de traditionele naam neohexylalcohol zijn, of neohexanol.
Voorbeelden
Ten slotte worden enkele voorbeelden van tertiaire alcoholen genoemd:
-2-methyl-2-propanol
-3-methyl-3-hexanol
-Biciclo [3,3,0] octan-1-ol
-2-methyl-2-butanol: ch3Ch2Coh (ch3))2
De formules van de eerste drie alcoholen worden weergegeven in het eerste beeld.
Referenties
- Carey F. (2008). Organische chemie. (Zesde editie). MC Graw Hill.
- Morrison, r. T. en Boyd, R, n. (1987). Organische chemie. (5e editie). Redactionele addison-wesley inter-Amerikaan.
- Graham Solomons T.W., Craig B. Friteuse. (2011). Organische chemie. Amines. (10e editie.)). Wiley Plus.
- Gunawardena Gamini. (31 januari 2016). Tertiaire alcohol. Chemistry Libhethexts. Hersteld van: chem.Librhetxts.borg
- Ashenhurst James. (16 juni 2010). Alcoholen (1) - Nomenclatuur en eigenschappen. Hersteld van: MasterGanicChemistry.com
- Clark J. (2015). Alcoholen introduceren. Hersteld van: chemguide.co.Uk
- Organische chemie. (S.F.)). Thema 3. Alcohol. [PDF]. Hersteld van: sinorg.Uji.is
- Nilanjana Majumdar. (3 maart 2019). Synthese van chirale tertiaire alcohol: belangrijke ontwikkelingen. Hersteld van: 2.Scheikunde.MSU.Edu
- « Formatieve periode van Amerikaanse oorsprong, kenmerken, producten
- Hoe was de Europese samenleving in de eerste helft van de negentiende eeuw »

