Secundaire alcohol wat is, structuur, eigenschappen, gebruik
- 3748
- 222
- James Dach
Wat is een secundaire alcohol?
A secundaire alcohol Het heeft de koolstofkoolstof van de hydroxylgroep (OH), bevestigd aan twee koolstofatomen. Ondertussen is in primaire alcohol de koolstofkoolstof van de hydroxylgroep gekoppeld aan een koolstofatoom en in de tertiaire alcohol bevestigd aan drie koolstofatomen.
Alcoholen zijn iets zwakkere zuren dan water, met de volgende PKA: water (15,7); Methylalcoholen (15,2), ethyl (16), isopropyl (secundaire alcohol, 17) en thermisch (18). Zoals te zien is, is isopropylalcohol minder zuur dan methyl- en ethylalcoholen.
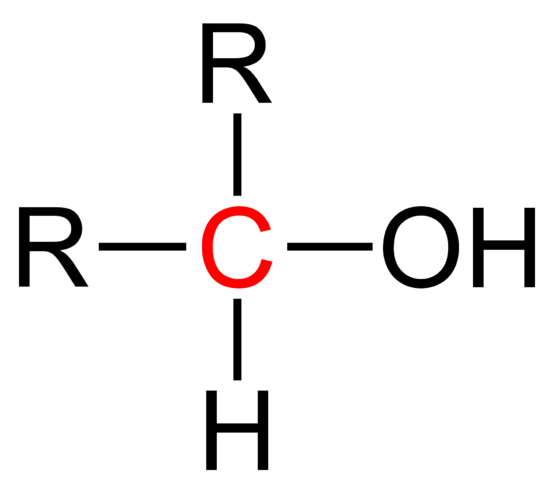
 Structurele formule van een secundaire alcohol. Wikimedia Commons
Structurele formule van een secundaire alcohol. Wikimedia Commons In het bovenste beeld wordt de structurele formule voor een secundaire alcohol getoond. Rode koolstof is de drager van OH en is gekoppeld aan twee alkyl (of aryl) R -groepen en een enkele waterstofatoom.
Alle alcoholen hebben de ROH -generieke formule; Maar als de koolstofkoolstof in detail wordt waargenomen, worden de primaire alcoholen verkregen (RCH2Oh), secundair (r2Choh, hier opgegroeid) en Tertiary (r3Coh). Dit feit maakt een verschil in zijn fysieke eigenschappen en reactiviteit.
Structuur van een secundaire alcohol
Alcoholstructuren zijn afhankelijk van de aard van R -groepen. Voor secundaire alcoholen kan echter enige voorbeeld worden gemaakt, aangezien er alleen lineaire structuren kunnen zijn met of zonder vertakkingen, of cyclische structuren. U hebt bijvoorbeeld de volgende afbeelding:
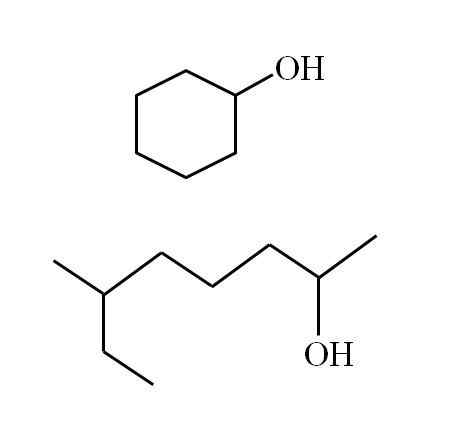 Een cyclische secundaire alcohol en een andere vertakte ketting. Bron: Gabriel Bolívar
Een cyclische secundaire alcohol en een andere vertakte ketting. Bron: Gabriel Bolívar Merk op dat er voor beide structuren iets gemeen is: OH is gekoppeld aan een "V". Elk uiteinde van de V vertegenwoordigt een gelijke groep (bovenste deel van het beeld, cyclische structuur) of anders (onderste deel, vertakte ketting).
Op deze manier wordt elke secundaire alcohol heel gemakkelijk geïdentificeerd, zelfs als de nomenclatuur überhaupt onbekend is.
Eigenschappen
Kookpunten
De eigenschappen van secundaire alcoholen verschillen niet teveel van andere alcoholen. Het zijn meestal transparante vloeistoffen, en om een vaste stof bij kamertemperatuur te zijn, moet het verschillende waterstofbruggen vormen en een hoge moleculaire massa hebben.
Het kan u van dienst zijn: perbrominezuur (hbro4): eigenschappen, risico's en gebruikDezelfde structurele formule r2Choh suggereert bepaalde unieke eigenschappen in het algemeen voor deze alcoholen. De OH -groep is bijvoorbeeld minder blootgesteld en beschikbaar voor interacties voor waterstofbruggen, r2Ch-oh-ohchr2.
Dit komt omdat de R -groepen, grenzend aan de koolstofkoolstof van de auto, kunnen worden gebracht en de vorming van waterstofbruggen belemmert. Als gevolg hiervan hebben secundaire alcoholen lagere kookpunten dan primair (RCH2OH).
Zuurgraad
Volgens de definitie van Brönsted-Lowry is een zuur een dat protonen of waterstofionen doneert, h+. Wanneer dit gebeurt met een secundaire alcohol, heb je:
R2CHOH + B- => R2Cho- + HB
De geconjugeerde RAS2Cho-, Alcoxide -anion, uw negatieve belasting moet stabiliseren. Voor secundaire alcohol is stabilisatie lager omdat de twee R -groepen een elektronische dichtheid hebben, die de negatieve belasting op het zuurstofatoom tot op zekere hoogte afstoten.
Ondertussen, voor het alkoxide -anion van een primaire alcohol, RCH2OF-, Er is minder elektronische afstoting met slechts één R -groep en niet twee. Bovendien oefenen waterstofatomen geen significante afstoting uit, en integendeel dragen ze bij om de negatieve belasting te stabiliseren.
Daarom zijn secundaire alcoholen minder zuur dan primaire alcoholen. Als dit zo is, dan zijn ze eenvoudiger, en precies om dezelfde redenen:
R2CHOH + H2B+ => R2Koheren2+ + HB
Nu stabiliseren R -groepen de positieve belasting in zuurstof door een deel van hun elektronische dichtheid te geven.
Reacties
Waterstofhallogenide en fosfor trihalogenide
Een secundaire alcohol kan reageren met een waterstofhalogenide. De chemische vergelijking van de reactie tussen isopropylalcohol en bromhytericzuur wordt getoond in een middel van zwavelzuur en het produceren van isopropylbromide:
Ch3Hokje3 + Hbr => ch3Chbrch3 + H2OF
En je kunt ook reageren met een trihalogenuero van fosforus, px3 (X = br, i):
Het kan u van dienst zijn: nikkelhydroxide (iii): structuur, eigenschappen, gebruik, risico'sCh3-Choh-CH2-Ch2-Ch3 + PBR3 => CH3-CHBR-CH2-Ch2-Ch3 + H3Po3
De chemische stof van bovenstaande komt overeen met de reactie tussen de sectie en het fosfortribromide, waardoor SEC-pentil bromide wordt veroorzaakt.
Merk op dat er in beide reacties een secundair alkylhalogenide is (r2CHX).
Uitdroging
In deze reactie gaan een H en een OH van naburige koolstofatomen verloren, waardoor een dubbele binding wordt gevormd tussen deze twee koolstofatomen. Daarom is er de vorming van een alkeen. De reactie vereist een zuurkatalysator en warmtevoorziening.
Alcohol => alkene + h2OF
U hebt bijvoorbeeld de volgende reactie:
Cyclohexanol => cyclohexen + h2OF
Reactie met actieve metalen
Secundaire alcoholen kunnen reageren met metalen:
Ch3-Choh-CH3 + K => cho3Cho-K+Ch3 + ½ H+
Hier reageert isopropylalcohol met kalium om kalium isoproxide en waterstofionen te vormen.
Verestering
Secundaire alcohol reageert met een carbonzuur om een ester te ontstaan. De chemische vergelijking van de reactie van sechutilische alcohol wordt bijvoorbeeld getoond met azijnzuur, om semi-butylacetaat te produceren:
Ch3Hokje2Ch3 + Ch3COOH CH3Coochch3Ch2Ch3
Oxidatie
Primaire alcoholen oxideren aldehydos, en deze oxideren op hun beurt carbonzuren. Maar secundaire alcoholen oxideren aceton. De reacties worden meestal gekatalyseerd door kaliumdichromaat (k2Cro7) en chroomzuur (h2Cro4)).
De globale reactie is:
R2CHOH => R2C = O
Nomenclatuur
Secundaire alcoholen worden benoemd door te wijzen op de positie van de OH -groep in de hoofdketen (langer). Dit nummer gaat vooraf aan de naam, of kan de naam van de respectieve alkane voor genoemde keten volgen.
Bijvoorbeeld cho3Ch2Ch2Ch2Hokje3, Het is de 2-hexanol of hexan-2-to.
Als de structuur cyclisch is, is het niet nodig om een teller te plaatsen; tenzij er andere substituenten zijn. Dat is de reden waarom de cyclische alcohol van het tweede beeld cyclohexanol wordt genoemd (de ring is zeshoekig).
Kan u van dienst zijn: aminesEn voor de andere alcohol van dezelfde afbeelding (de vertakte), is de naam: 6-ethyl-heptan-2 -ol.
Toepassingen
-Sec-butanol wordt gebruikt als oplosmiddel en tussenliggende chemische stof. Het is aanwezig in de hydraulische vloeistoffen voor remmen, industriële schoonmakers, polijsten, pinting, minerale flotatiemiddelen en fruit en parfum essenties.
-Isopropanolalcohol wordt gebruikt als een industrieel oplosmiddel en als een anticoagulans. Het wordt gebruikt in oliën en snel drogende inkten, zoals antiseptica en vervanging voor cosmetica -ethanol (bijvoorbeeld: huidlotions, capillair tonic en wrijving alcohol).
-Isopropanol is een ingrediënt van vloeibare zeep, kristalreinigers, synthetische aromatizers van niet -alcoholische dranken en voedsel. Bovendien is het een tussenliggende chemische stof.
-Cyclohexanol wordt gebruikt als een oplosmiddel, in de weefselafwerking, bij de verwerking van leer en emulgerende zeep en synthetische wasmiddelen.
-Methylciclohexanol is een ingrediënt van kauwproducten op basis van zeep- en wasmiddelen voor speciale weefsels.
Voorbeelden
2-octhanol
 2-Tortanol-molecuul. Bron: Jü [Public Domain], van Wikimedia Commons
2-Tortanol-molecuul. Bron: Jü [Public Domain], van Wikimedia Commons Het is een vette alcohol. Het is een kleurloze vloeistof, weinig oplosbaar in water, maar oplosbaar in de meeste niet -polaire oplosmiddelen. Het wordt onder andere gebruikt bij de uitwerking van smaken en geuren, schilderijen en coatings, inkten, lijmen, huishoudelijke zorg en smeermiddelen.
Estradiol of 17β-stradiol
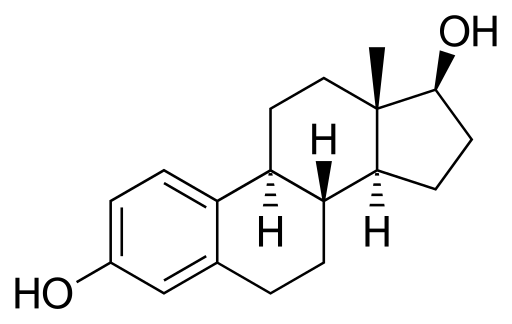 Estradiolmolecuul. Bron: Neurotoger [Public Domain], van Wikimedia Commons
Estradiolmolecuul. Bron: Neurotoger [Public Domain], van Wikimedia Commons Het is een steroïde seksueel hormoon. Het heeft twee hydroxilli -groepen in zijn structuur. Het is het overheersende oestrogeen tijdens de reproductieve jaren.
20-hydroxy-leukotrieen
Het is een metaboliet die waarschijnlijk afkomstig is van de oxidatie van leukotrieen lipide. Het is geclassificeerd als een leukotrieen cystinyl. Deze verbindingen zijn mediatoren van het ontstekingsproces die bijdragen aan de pathofysiologische kenmerken van allergische rhinitis.
2-heptanol
Het is een alcohol gevonden in fruit. Bovendien wordt het gevonden in gemberolie en aardbeien. Het is transparant, kleurloos en onoplosbaar in water. Het wordt gebruikt als een oplosmiddel van verschillende harsen en grijpt in de flotatiefase in bij minerale verwerking.
Referenties
- Encyclopedie van gezondheid en veiligheid op het werk. (S.F.)). Alcohol. [PDF]. Hersteld van: insht.is
- Structuur en classificatie van alcoholen. Chemistry Libhethexts. Hersteld van: chem.Librhetxts.borg

