Ethylalcoholstructuur, eigenschappen, gebruik, verkrijgen
- 2469
- 59
- Ernesto McKenzie
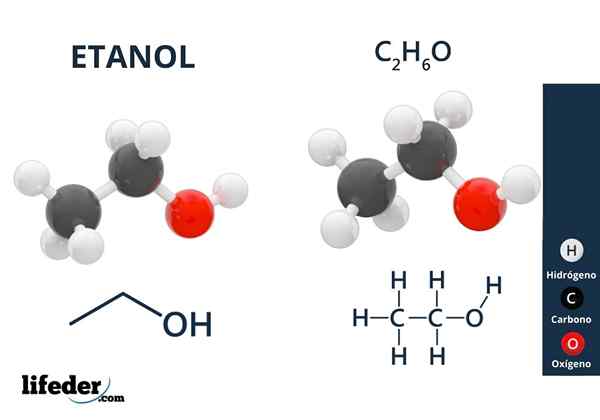
Hij Ethylalcohol of ethanol Het is een organische verbinding waarvan de formule c is2H5Oh of ch3Ch2Oh, presenteert zichzelf als een kleurloze vloeistof. Dit is de tweede eenvoudigste primaire alcohol van allemaal na methanol. Het is erg oplosbaar in water en in veel organische oplosmiddelen, die de ontwikkeling van veel van zijn toepassingen mogelijk hebben gemaakt.
Deze alcohol is gebruikt als antiseptisch en desinfectiemiddel, naast het gebruik ervan bij de synthese van medicijnen en andere organische chemicaliën. Het is ook gebruikt als brandstof in verwarming, lampen en in combinatie met benzine in motorvoertuigen.

De gisting van suiker voor ethanolproductie is een van de eerste chemische reacties die de primitieve man heeft geleerd. Een 9000 -jarige keramiek is gevonden in China.
Maar suikersfermentatie produceerde slechts een ethanoloplossing met een zeer lage concentratie, daarom was het nodig om destillatietechnieken te leren om water te elimineren en alcohol te concentreren. Zo werkten Griekse alchemisten die in de 1e eeuw in Alexandrië werkten.C., Ze kenden de destillatie al en gebruikten.
Er zijn echter synthetische routes die het mogelijk maken om volledig zuivere ethanol te verkrijgen op basis van ethyleen, dat uit olie wordt gedestilleerd. Daarom is olie een indirecte bron van ethanol. Op deze manier wordt ethanol of absolute alcohol verkregen.
[TOC]
Ethylalcoholstructuur
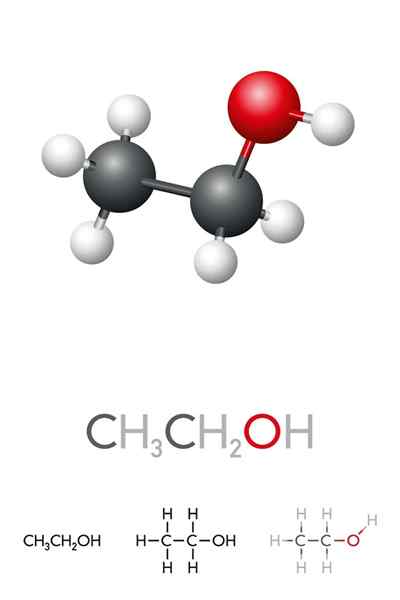
In het superieure beeld hebben we de moleculaire structuur van ethanol, cho3-Ch2-Oh, vertegenwoordigd door een full space -model. Het is een nogal polaire moleculair, omdat de OH -groep elektronische dichtheid naar zichzelf trekt van het koolstofkelet waaraan het is gekoppeld.
Als gevolg hiervan werken ethylalcoholmoleculen samen via dipool-dipol3Ch2Oh-ohch2Ch3. Daarom heeft deze alcohol een hoog kookpunt in vergelijking met andere organische oplosmiddelen of vloeistoffen.
Eigenschappen
Fysiek uiterlijk
Kleurloze vloeistof.
Molaire massa
46.069 g/mol
Geur
Zachte geur en vergelijkbaar met wijn.
Smaak
Brandwond.
Dikte
0.789 g/cm3 bij 20 ºC
Smeltpunt
- 114.14 ºC
Kookpunt
78.24 ºC
Oplosbaarheid in water
1 · 106 mg/l. Dat wil zeggen, het is praktisch mengbaar in alle verhoudingen.
Mengbaarheid met organische oplosmiddelen
Ethanol is mengbaar met azijnzuur, aceton, benzeen, koolstoftetrachloride, chloroform, Dietylether, ethyleenglycol, glycerol, pyridine en tolueen. Het is ook mengbaar met lichte alifatische koolwaterstoffen, zoals Pentano en Hexano.
Octanol/waterpartitiecoëfficiënt
Log p = - 0.31
Dampdruk
59.3 mm Hg bij 25 ºC. Daarom heeft een waarneembare hoeveelheid dampen afgewezen.
Kan u van dienst zijn: bariumchloride (BACL2)Dampdichtheid
1.59 in luchtrelatie genomen als eenheid (1)
ontstekingspunt
13 ºC
Zelf -richtingtemperatuur
363 ºC
Verbranding warmte
1336.8 kJ/mol A 25 ºC
Verbranding
Ethanol is een vluchtige vloeistof die brandt met een blauwe vlam, zonder rook, en die praktisch onzichtbaar is voor natuurlijk licht.
Specifieke hitte
0.618 limoen/g bij 23 ° C
Smurrie
1.2 MPa · S bij 20 ºC
Brekingsindex ηd
1.3611
Gebruik van ethylalcohol
 Een van de meest voorkomende toepassingen van alcohol is als antisepticum
Een van de meest voorkomende toepassingen van alcohol is als antisepticum Medisch gebruik
Antiseptisch
Ethanol wordt gebruikt als een antisepticum, omdat het een dodelijke actie heeft tegen bacteriën en schimmels. Het is in staat om de structuur van zijn plasmamembranen te veranderen, die zijn vernietiging veroorzaakt door de gevestigde osmotische waterstromen.
Evenzo kan ethanol vele soorten virussen vernietigen. Op dit moment wordt het gebruik van gels die alcohol bevatten om hun handen te desinfecteren en besmetting met de coronavirus te verminderen. Ethanol wordt ook gebruikt bij desinfectie van oppervlakkige kleine wonden.
Drugsoplosmiddel
Veel medicijnen zijn weinig oplosbaar in water en gebruiken ethanol om hun oplosbaarheid te verhogen. Sommige spenen voor hoest- en mondspoelingen hebben een ethanolvertoning van maximaal 25%.
Pijnbehandeling
Ethanol wordt gebruikt voor de therapeutische lysis van zenuwen of ganglia voor de verlichting van chronische hardnekkige pijn, aanwezig in onbruikbare kanker of in een trigeminale neuralgie.
Symptomatische schildkliercystenbehandeling
Percutane ethanolinjecties worden gebruikt bij de behandeling van schildkliercysten, een eenvoudige procedure die complicaties van chirurgische interventie kan voorkomen.
Sedatieve actie
Af en toe wordt ethanol intraveneus toegediend voor preoperatieve en postoperatieve sedatie, bij patiënten aan wie andere maatregelen niet bruikbaar zijn.
Tegengif
Ethanol wordt systemisch gebruikt voor de behandeling van vergiftiging met methanol of ethyleenglycol.
Glaucoom
Ethanol wordt gebruikt om de intraoculaire druk bij glaucoompatiënten te verminderen.
Brandstof
Verenigde Staten verbruikt samen met Brazilië 90% van de ethanol die wordt gebruikt als brandstof in auto's. De Verenigde Staten zijn de grootste maïsproducent ter wereld, dus het gebruikt maïs als een bron van ethanol als brandstof.
De overheid subsidieerde maïskwers, die tussen 1979 en 1986 de productie van brandstofethanol van 20 miljoen gallons per jaar toegenomen tot 750 miljoen gallons.
Suikerriet is de belangrijkste bron van ethanol in Brazilië voor gebruik als brandstof. In 1943, vanwege de Tweede Wereldoorlog.
Kan u van dienst zijn: deuteriumSinds 1976 worden ze gebruikt als brandstof in auto -mengsels van ethanol en benzine, wiens ethanolgehalte tussen 10 en 25 %varieert, afhankelijk van de productie van suikerriet.
Recreatief gebruik
Ethanol is aanwezig in talloze drankjes die worden gebruikt in sociale vergaderingen en zelfs tijdens de lunch- en familiediner.
De initiële actie van alcohol om het sociale gedrag van de persoon te schrappen, produceert een aangename en faciliterende omgeving van de interactie tussen mensen. Overmaat ethanol kan echter giftige en ongewenste effecten op persoonlijke gezondheid en in harmonie tussen vergaderingen of gebeurtenissen ontploffen.
Persoonlijke verzorging
Ethanol is aanwezig in veel cosmetica en schoonheidsproducten. Bovendien wordt het vanwege de samentrekkende actie gebruikt bij het reinigen van de huid, het elimineren van vet en vuile overblijfselen dat water en zeep het niet doen. Het maakt ook deel uit van de voorbereiding van veel lotions en parfums.
Voedsel
De essentie van vanille, een smaak van gebruik in cakes en cakes, wordt opgelost in een mengsel van ethanol en water. Snoepjes die gevuld zijn met bepaalde alcoholische dranken worden verkocht. Alcohol wordt ook gebruikt als een voorproefje van wat snoep.
Ethylalcohol verkrijgen
Ethanol wordt voornamelijk verkregen door suikerfermentatie en ethyleenhydratatie, repeteren om het te produceren uit koolstofdioxide, lipiden en cellulose.
Fermentatie
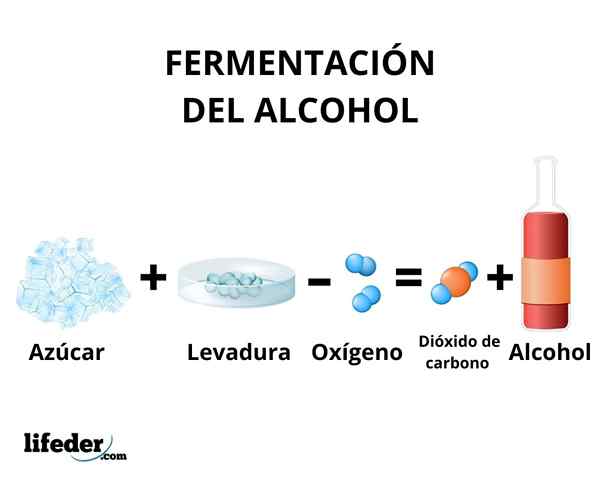
In het fermentatieproces vindt de transformatie van koolhydraten in ethanol plaats door de werking van enzymen in de gist. Voornamelijk worden suikerriet, bieten en granen zoals maïs en gerst gebruikt als grondstof.
De enzymen van de glycolyse van sommige gistsoorten, zoals Saccharomyces cerevisiae, Ze zijn in staat om te handelen op glucose- en sucrosesuikers, om ethanol te produceren. De geproduceerde concentratie van ethanol wordt beperkt door de gevoeligheid van gisten voor ethanol.
In elk geval is de concentratie ethanol geproduceerd door fermentatie niet meer dan 18%. Het is noodzakelijk om de ethanoloplossing te concentreren met behulp van eenvoudige destillatie. Via deze methode wordt een ethanoloplossing verkregen met een concentratie rond 95%.
Ten slotte worden gefractioneerde destillatie en 95% alcohol uitdroging voor absolute alcoholproductie gebruikt. Ethanol geproduceerd door fermentatie wordt gebruikt in de geneeskunde en is gereserveerd als een brandstof die een aanvulling vormt op benzine.
Ethyleenhydratatie
In dit proces wordt ethyleen gemengd met hoge temperaturen met gedeïoniseerde stoom bij hoge temperaturen, tussen 250 en 300 ° C, en onder een druk van 6.8 MPA. De omzetting van ethyleen in ethanol wordt gekatalyseerd door fosforzuur geplaatst op een silica- of diatomee -landbed.
Kan u van dienst zijn: mechanische eigenschappen van metalenEthyleenhydratatiereactie kan als volgt worden gepresteerd:
C2H4 + H2O → ch3Ch2Oh
Een deel van fosforzuur wordt gesleept door waterdamp en moet worden geneutraliseerd met verdund natriumhydroxide. De concentratie ethanol verkregen door ethyleenhydratatie is laag, met een waarde tussen 10 en 25%.
Vervolgens wordt de ethanoloplossing geconcentreerd door destillatie, waarbij een 95% ethanoloplossing wordt verkregen, die 100% kan worden uitgevoerd door fractionele dehydratatie.
Andere methodes
Van alternatieve methoden voor ethanolproductie hebben we het gebruik van koolstofdioxide, lipiden en cellulose. Het gebruik van cellulose is veelbelovend, omdat materialen zoals hout, stro, afvalpapier, enz., Als bron van cellulose -grondstof. Cellulose is een glucosepolymeer en kan worden gebruikt als een bron van deze koolhydraten.
Toxiciteit en risico's
 Zelfgemaakte alcoholboten worden meestal gevonden in een concentratie van 70%-90%
Zelfgemaakte alcoholboten worden meestal gevonden in een concentratie van 70%-90% Inademing
Hoge concentraties ethanolstoom kunnen slaperigheid, oogirritatie en bovenste luchtwegen veroorzaken, gemanifesteerd door hoest en hoofdpijn.
Direct contact met huid en ogen
Huidcontact kan droogheid en chronische, irritatie en dermatitis veroorzaken. Ondertussen produceert oogcontact irritatie, roodheid, pijn en brandend gevoel.
Inname
Produceert een brandend gevoel en in eerste instantie heeft het een stimulerende en aangename actie vanwege de geproduceerde ontheffing. Maar wanneer de alcoholinname doorgaat, is er een zenuwdepressie, hoofdpijn, wazig zicht, slaperigheid en bewusteloosheid.
Chronische effecten
Ethanol beïnvloedt het centrale zenuwstelsel en de bovenste luchtwegen. Bovendien kan de leverschade veroorzaakt door inname van ethanol leiden tot cirrose en vervolgens de dood.
Referenties
- Graham Solomons T.W., Craig B. Friteuse. (2011). Organische chemie. (10e Editie.)). Wiley Plus.
- Carey F. (2008). Organische chemie. (Zesde editie). MC Graw Hill.
- Morrison en Boyd. (1987). Organische chemie. (Vijfde editie). Addison-Wesley IberoAmericana.
- Wikipedia. (2020). Ethanol. Opgehaald uit: in.Wikipedia.borg
- Nationaal centrum voor biotechnologie -informatie. (2020). Ethanol. PubChem Comunund Samenvatting voor CID 702. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- Ethanolgeschiedenis. (2011). Ethanolgeschiedenis - van alcohol tot autofrandstof. Hersteld van: ethanolhistorie.com
- De redacteuren van Enyclopaedia Britannica. (2020). Ethanol. Hersteld van: Britannica.com
- Kreupel. (15 oktober 2000). Veiligheidsblad (MSDS) Ethylalcohol. [PDF]. Hersteld van: iio.Ent.UABC.mx
- Byju's. (2020). Gebruik van methanol en ethanol. Hersteld van: byjus.com
- Helmestine, Anne Marie, pH.D. (25 augustus 2020). Het verschil tussen alcohol en ethanol. Hersteld van: Thoughtco.com

