Sluiten
- 3612
- 1028
- James Dach
We leggen uit wat de alkanen, hun eigenschappen, nomenclatuur, types zijn en geven verschillende voorbeelden
Wat zijn de Alkanes?
De Sluiten zijn de eenvoudigste organische verbindingen die bestaan. Ze zijn verzadigde alifatische koolwaterstoffen, uitsluitend gevormd door koolstof en waterstof, waarbij koolstofatomen alleen verenigd zijn door middel van eenvoudige eenvoudige covalente bindingen.
Ze kunnen een open ketting zijn, in welk geval ze de algemene formule C hebbenNH2n+2. Ze kunnen ook een of meer cycli vormen, in welk geval de algemene formule twee hydrogenen verliest voor elke gevormde cyclus (cNH2n Als ze een enkele cyclus hebben, cNH2N-2 Als ze 2, etc. hebben.)).
Veel veel voorkomende organische verbindingen die we elke dag gebruiken, worden bereikt. Keukengas en aardgas wordt bijvoorbeeld gevormd door een of meer gasvormige alkanen. De brandstof voor auto's (benzine, benzine of brandstof, afhankelijk van het land) bestaat uit complexe mengsels van vloeibare alkanen, waaronder de belangrijkste de isomeren van het octaan.
Alcean -eigenschappen
Ze zijn heel weinig reactief
De belangrijkste chemische eigenschap of eigenschap van alkanen is dat het vrij stabiele moleculen zijn die niet deelnemen aan chemische reacties, tenzij het zich in zeer energieke omstandigheden bevindt, zoals zeer hoge temperaturen of in aanwezigheid van ultraviolet licht of vrije radicalen.
Het zijn apolaire verbindingen
Eenvoudige C-C- en C-links zijn apolaire covalente bindingen, dus alkanes moleculen kunnen geen netto dipoolmoment hebben. Daarom zijn het apolaire moleculen.
Ze hebben laag koken en fusiepunten
Vanwege hetzelfde feit dat ze apolair zijn, zijn de enige krachten van intermoleculaire aantrekkingskracht die de alkaos aanwezig zijn, de dispersiekrachten zoals de krachten van van der Waals. Omdat deze krachten erg zwak zijn, zijn ze gemakkelijk te breken om vaste stoffen te maken tot vloeistoffen en deze lage temperatuurgassen.
Ze zijn minder dicht dan water
De alkanen zijn de minst dichte organische verbindingen, en ze zijn altijd minder dicht dan water. Om deze reden drijven ze altijd op het wateroppervlak wanneer de twee worden gemengd.
Over het algemeen zijn ze kleurloos
Gasvormige en vloeibare alkanen zijn kleurloos en doorzichtig. Wanneer ze echter stollen, vormen ze witte ondoorzichtige amorfe vaste stoffen, zoals in het geval van sommige paraffines en enkele kunststoffen.
Ze zijn niet oplosbaar in water
De gouden regel voor oplosbaarheid is dat een soortgelijke oplossing voor dit. Water is een polair oplosmiddel, terwijl alle alkanen volledig apolair zijn, dus ze zijn niet oplosbaar in water.
Kan u van dienst zijn: diastreomerenZe zijn oplosbaar in apolaire organische oplosmiddelen
Met hetzelfde eerdere argument zijn de alkanen oplosbaar in apolaire oplosmiddelen zoals benzeen of cyclohexan. In feite maken vloeibare alkanen deel uit van apolaire organische oplosmiddelen.
Ze kunnen geen toevoegingsreacties lijden
Omdat ze verzadigde koolwaterstoffen zijn, kunnen alkanen geen toevoegingsreacties lijden. De enige uitzondering is het cyclopropaan dat een ring van slechts drie leden heeft die erg spanning is en gemakkelijk kan worden verbroken.
Het zijn brandstoffen
Een van de weinige chemische reacties waaraan de alkanen deelnemen, is verbranding, en dat is precies het belangrijkste gebruik dat aan hen wordt gegeven.
Soorten alkanen
Afhankelijk van de connectiviteit tussen koolstofatomen, kunnen alkanen zijn:
- Lineair
- Vertakt
- Cyclisch (cycloalcanos)
- Bicyl- of polycyclische totcons
- Spiranos
Lineaire alkanen
Ze zijn de eenvoudigste alkanes en daarom van alle organische verbindingen. Allen hebben moleculaire formule CNH2n+2 En ze worden gekenmerkt door een enkele keten van koolstofatomen na een andere te hebben gekoppeld.
Vertakking van alkanen
Ze hebben ook algemene formule CNH2n+2 Maar in tegenstelling tot lineaire alkanen, wordt de keten van koolstofatomen op een bepaald moment vertakt. De vertakte alkanen zijn ketting -isomeren van lineaire alkanen, omdat ze alleen verschillen in de volgorde waarin koolstofatomen zijn gekoppeld.
Cycloalcanos
In de cycloalcanos worden de uiteinden van de keten van lineaire alkanen samengevoegd om een cyclische ketting te vormen. Om deze extra C-C-binding te vormen, is het noodzakelijk om een waterstof uit elke terminale koolstof te elimineren, dus de algemene formule van deze verbindingen is CNH2n. De kleinst mogelijke cyclus is die van drie koolstofatomen die cyclopropaan worden genoemd (C3H6)).
Net als de open keten alkanen die gevolgen kunnen hebben, kan cycloalcan ook substituentgroepen presenteren in de vorm van open ketens.
Bicyl en polycyclische totC's
Er zijn veel cyclische toums waarin twee of meer cycli twee of meer koolstofatomen delen. Deze verbindingen worden politie genoemd. De moleculaire formule van de politie hangt af van hoeveel cycli de structuur.
In het eenvoudigste geval, fietsen, is de formule cNH2N-2 Aangezien een paar hydrogenen verloren moeten gaan om elke cyclus te sluiten. Voor politie met meer dan twee samengevoegde cycli zal de formule gelijk zijn aan die van alkanen minder een paar hydrogenen voor elke gevormde cyclus.
Kan u van dienst zijn: HydraceSpiranos
Spiranials zijn een speciale klasse van fietsen waarin de twee cycli slechts één koolstofatoom delen. In deze gevallen bevinden de twee cycli loodrechte vlakken met elkaar, dus de structuur wordt gezien alsof een van de cycli is geroteerd ten opzichte van de andere.
Nomenclatuur van Alkanes
Nomenclatuur van lineaire alkanes
De nomenclatuur van alkanes en in feite is die van alle organische verbindingen gebaseerd op de nomenclatuur van lineaire alkanen. Deze worden eenvoudig genoemd volgens het aantal koolstofatomen in de keten.
De eerste vier ontvangen gemeenschappelijke namen die methaan zijn, Ethan.) Aan het einde van Alcano.
Aantal koolstofatomen | Moleculaire formule | Semi -ontwikkelde formule | Naam |
1 | CH4 | CH4 | Methaan |
2 | C2H6 | CH3CH3 | Etano |
3 | C3H8 | CH3CH2CH3 | Propaan |
4 | C4H10 | CH3 (CH2) 2CH3 | Butaan |
5 | C5H12 | CH3 (CH2) 3CH3 | Pentano |
6 | C6H14 | CH3 (CH2) 4CH3 | Hexaan |
7 | C7H16 | CH3 (CH2) 5CH3 | Heptano |
8 | C8H18 | CH3 (CH2) 6CH3 | Octaan |
9 | C9H20 | CH3 (CH2) 7CH3 | Nonano |
10 | C10H22 | CH3 (CH2) 8CH3 | decaan |
Nomenclatuur van vertakte alkalen
De vertakte alkanen worden genoemd op de naam lineaire alkanes. Het proces omvat het selecteren van een van de mogelijke koolstofketens zoals de hoofdketen en de rest van de vertakkingen blijven als substituerende groepen.
Het proces bestaat uit de volgende stappen:
Stap 1: Identificeer de hoofdketen.
De selectie wordt gemaakt volgens de volgende criteria in volgorde van prioriteit:
- De langste ketting is geselecteerd.
- Als er meer dan één is, worden de meeste gevolgen van hen geselecteerd.
- In het geval van meer dan één die dezelfde lengte heeft en hetzelfde aantal gevolgen, is degene die, bij het nummeren ervan, de kleinst mogelijke locatorcombinatie geeft, is geselecteerd.
- Als twee of meer ketens dezelfde lengte hebben, zijn hetzelfde aantal gevolgen en allemaal dezelfde locators, degenen die de minderjarigen locators toewijzen aan de gevolgen die eerst in alfabetische volgorde verschijnen, worden geselecteerd.
- In het geval dat al het bovenstaande hetzelfde is, kan iedereen worden gekozen.
De hoofdketen geeft de hoofdnaam aan de alkane, alsof het een lineaire alkaan is.
Het kan u van dienst zijn: kaliumnitriet (kno2): structuur, eigenschappen en gebruikStap 2: Nummer de hoofdketen.
Koolstofatomen van de hoofdketen in volgorde van het ene uiteinde naar het andere moeten worden vermeld, volgens deze regels:
- De nummering die wordt toegewezen door de laagste combinatie van locators aan de gevolgen is geselecteerd.
- Als de twee nummers dezelfde combinatie van locators geven, wordt deze geselecteerd die door de locators van minderjarigen worden toegewezen aan de gevolgen die eerst in de alfabetische volgorde verschijnen.
- In het geval dat beide hetzelfde zijn, maakt het niet uit welke wordt gekozen.
Stap 3: Noem de gevolgen en bestel ze alfabetisch.
De vertakkingen worden genoemd als radicalen, ter vervanging van de _ano van de overeenkomstige lineaire alkaan door het _ilo -einde.
Aantal koolstofatomen | Radicaal alkyl | Naam |
1 | -CH3 | Stadelijk methyl |
2 | -CH2CH3 | "Ethyl |
3 | -CH2CH2CH3 | "Propy |
4 | -CH2 (CH2) 2CH3 | "Butyl |
5 | -CH2 (CH2) 3CH3 | "Pentilo |
6 | -CH2 (CH2) 4CH3 | "Hexilo |
7 | -CH2 (CH2) 5CH3 | "Heptyl |
8 | -CH2 (CH2) 6CH3 | "Octilo |
9 | -CH2 (CH2) 7CH3 | "Nonilo |
10 | -CH2 (CH2) 8CH3 | "Decil |
Stap 4: De naam van de verbinding is gebouwd.
De naam wordt gebouwd door alle gevolgen in alfabetische volgorde te noemen (de laatste "O" -brief van de huur te onderdrukken), voorafgegaan door de locator, gevolgd door de naam van de hoofdketen.
Als een tak wordt herhaald, worden de locators van elk geplaatst, gescheiden door komma's, en plaatsen het voorvoegsel dat aangeeft hoe deze wordt herhaald voor 2, tri voor 3, enzovoort) wordt voorafgegaan door de tak, enzovoort).
Voorbeeld:
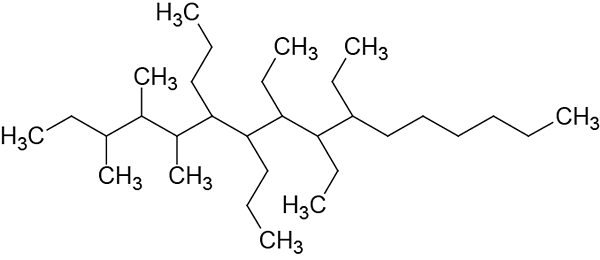
Noem de volgende vertakte alkane:

Stap 1: Selectie van de hoofdketen.
Deze ketting heeft 16 koolstofatomen, dus de hoofdketen zal worden genoemd Hexadecano.
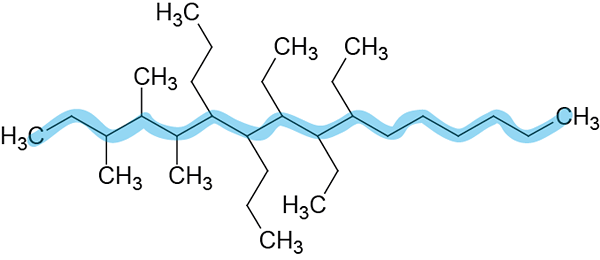
Stap 2: Nummering van de hoofdketen.
Het is genummerd van links naar rechts omdat ze de kleine locators geven.
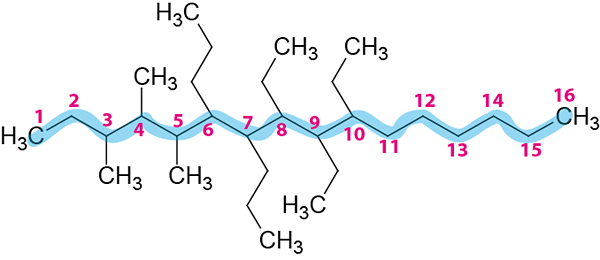
Stap 3: Noem alle gevolgen.
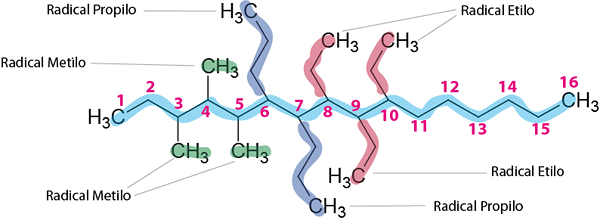
Er zijn drie ethylradicalen, drie methylradicalen en twee propylradicalen.
Stap 4: Bouw de naam
De naam van de compound zal zijn:
8,9,10-trietil-3,4,5-trimethyl-6.7-dipropilhexadecano
Voorbeelden van alkanes
In de volgende tabel worden enkele aanvullende voorbeelden van alkanen gepresenteerd.
Naam | Moleculaire formule of structuur | Radicaal | Aantal koolstofatomen |
Methaan | CH4 | Methyl | 1 |
Etano | C2H6 | Ethyl | 2 |
Propaan | C3H8 | Propil | 3 |
N-butane | C4H10 | N-Blight | 4 |
Isobutaan | C4H10 | Isobutil | 4 |
N-pentaan | C5H12 | N-pentiel | 5 |
Isopentano | C5H12 | Isopentiel | 5 |
Neopentano | C5H12 | Neopentilo | 5 |
N-hexaan | C6H14 | N-hexyl | 6 |
Polyethyleen | CH3 (CH2) NCH3 | ---- | > 100 |
Cyclopentano | C5H10 | Cyclopentiel | 5 |
Cyclohexan | C6H12 | Cyclohexil | 5 |

