Ammoniumacetaatstructuur, eigenschappen, gebruik en risico's

- 4573
- 1381
- Pete Heaney V
Hij Ammoniumacetaat Het is een anorganisch zout waarvan de chemische formule NH is4Ch3COOH. Het is afgeleid van het mengsel van azijnzuur, aanwezig in commerciële azijn tot een concentratie van 5%, en de ammoniak. Beide startende stoffen hebben karakteristieke geuren, dus het is mogelijk om een idee te krijgen van waarom dit zout ruikt naar azijn-ammonia.
Het meeste hoogtepunt van dit zout is echter niet de geur, maar het lage smeltpunt. Het is zo laag, dat het in elk laboratorium kan worden verkregen in zijn vloeibare versie, waar ionen vrij stromen om elektrische belastingen te transporteren.
 Ammoniumacetaatkristallen. Bron: Vidak [Public Domain].
Ammoniumacetaatkristallen. Bron: Vidak [Public Domain]. Aan de andere kant is het ammoniumacetaat heerlijk; dat wil zeggen, absorberen water of vochtigheid van de omgeving tot het volledig is opgelost. Dat is de reden waarom, hoewel in watervrij toestand hun kristallen wit zijn, ze snel helder worden (zoals die in de beker van het bovenste beeld).
Als een solide bron van ammoniak, moet het zodanig worden gemanipuleerd dat het inademen van zijn dampen wordt geminimaliseerd. Maar ondanks dit negatieve kenmerk, de NH4Ch3COOH is nuttig voor de bereiding van bufferoplossingen die voedsel behouden, terwijl het een onderdeel is van bepaalde oplosmiddeleiwitextractors.
[TOC]
Ammoniumacetaatstructuur
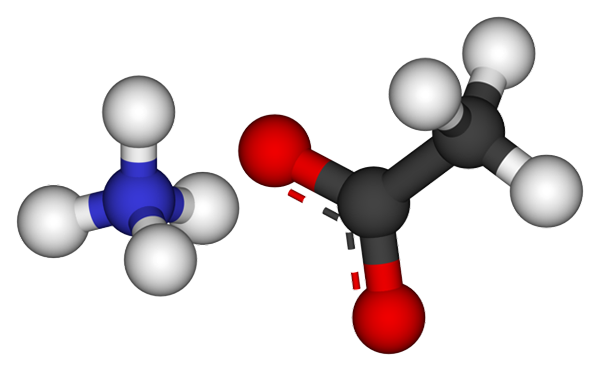 Ammoniumacetaationen. Bron: CCOIL [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)]
Ammoniumacetaationen. Bron: CCOIL [CC BY-SA 3.0 (https: // creativeCommons.Org/licenties/by-sa/3.0)] De bovenste afbeelding toont de ionen die het ammoniumacetaat vormen in een bollen en stavenmodel. Links is het tetraëdrische geometrie kation, NH4+, Terwijl aan uw recht is het moleculaire anion met twee gedemoceerde elektronen tussen twee zuurstofatomen, CH3Coo- (De stippellijn tussen de rode bollen).
Dus beide ionen, NH4+ en ch3Coo-, Ze blijven verenigd door hun elektrostatische aantrekkingskracht die, samen met de afstotingen tussen de gelijke belastingen, uiteindelijk een kristal definiëren. Dit ammoniumacetaatkristal heeft een ortorrombische structuur, die kan worden waargenomen in microscopische monsters of zelfs zichtbare maten.
Kan u van dienst zijn: Ionische link: kenmerken, hoe het is gevormd en voorbeeldenNiet alleen is de ionische binding voor dit zout belangrijk, maar ook waterstofbruggen. De NH4+ U kunt maximaal vier van deze bruggen doneren; Dat wil zeggen, in elk van de hoekpunten van zijn tetraëdron is er een zuurstofatoom van een cho3Coo- buurman (h3N+-H-OCH3)).
In theorie moeten krachten in hun kristallen dan erg sterk zijn; Maar experimenteel komt het tegenovergestelde voor, omdat het slechts 114 ° C smelt. Daarom compenseren waterstofbruggen de zwakte van hun ionische binding niet, noch de lage reticulaire energie van het NH ortorrhrombisch glas4Ch3Coo.
Andere composities en water
In het begin werd gezegd dat ammoniumacetaat wordt bereid door azijnzuur en ammoniakzuur te mengen. Daarom kan zout ook worden uitgedrukt als: NH3Ch3COOH. Dus, afhankelijk van de samenstelling, kunnen andere structuren worden verkregen: NH3· 2CH3COOH, O NH3· 5CH3COOH, bijvoorbeeld.
Er werd ook vermeld dat het voldoende vocht absorbeert. Door dit te doen, bevat het watermoleculen in zijn kristallen, die gehydrolyseerd zijn3 of ch3COOH; En daarom straalt zout een geur uit van ammoniak of azijn.
Eigenschappen
Fysiek uiterlijk
Delicuescerende witte kristallen met een geur van azijn en ammoniak.
Molaire massa
77,083 g/mol.
Dikte
1.073 g/ml bij 25 ° C.
Smeltpunt
114ºC. Deze waarde is aanzienlijk lager in vergelijking met andere zouten of ionische verbindingen. Bovendien mist het een kookpunt vanwege de vorming van ammoniak, wat de afbraak van zout impliceert.
Oplosbaarheid
143 g/100 ml bij 20ºC. Let op uw buitengewone oplosbaarheid in water, die de affiniteit aantoont die watermoleculen voelen op de NH -ionen4+ en ch3Coo-, Hying ze in waterige bollen.
Kan u van dienst zijn: Hume-rothery-regelsZijn oplosbaarheid is niet zo in minder polaire oplosmiddelen. Bijvoorbeeld in 100 ml methanol bij 15 ° C 7,89 g NH oplossen4Ch3Coo.
Stabiliteit
Het is heerlijk, dus je moet voorkomen dat je in natte ruimtes opslaat. Ook ontleedt het, terwijl het water absorbeert en daarom ontleedt het.
Pka
9.9.
Deze constante komt overeen met de zuurgraad van het ammoniumion:
NH4+ + B NH3 + HB
Waar HB een zwak zuur is. Als de B -basis het water is, zal de hydrolysereactie reageren:
NH4+ + H2Of NH3 + H3OF+
In welke soort h3OF+ Definieer de pH van de oplossing.
Aan de andere kant draagt acetaat ook bij aan pH:
Ch3Coo- + H2Of ch3COOH + OH-
Dus beide soorten h3OF+ en oh- Ze worden geneutraliseerd door een pH 7 te geven, neutraal. Volgens PubChem hebben sterk geconcentreerde oplossingen van ammoniumacetaat echter een zure pH; wat betekent dat NH -hydrolyse overheerst4+ Over de keuze3Coo-.
Standaard training enthalpie
ΔFH298 = -615 kJ/mol.
Toepassingen
Analytisch
Waterige natriumacetaatoplossingen maken het mogelijk dat lood-, ijzer- en zinksulfaten worden opgelost, om vervolgens hun concentratie te bepalen door atoomabsorptiespectroscopie.
Halfchauffeur
Als maaltijden op lage temperaturen in vergelijking met andere zouten, kan de vloeistof worden gebruikt om de elektrische stroom aan te drijven die het circuit van een bol inschakelt.
Buffer
U kunt pH -veranderingen regelen in zure of basisintervallen, die worden gebruikt om een constante pH te behouden in bijvoorbeeld vlees, chocolaatjes, kazen, groenten of andere voedselproducten.
Kan u van dienst zijn: molybdeenumOp ijs en vloeren
Het is een biologisch afbreekbaar en relatief goedkoop zout, dat wordt gebruikt om ijzige paden te ontdooien. Omdat het een bron van in water oplosbare stikstof is, is het ook bedoeld voor landbouwgebruik voor de bepaling van de kaliumspiegels.
Neerslagmiddel
Dit zout wordt gebruikt om eiwit te neerslachten om chromatografische analyse uit te voeren.
Geneesmiddel
Ammoniumacetaat werkt als een veterinair diuretisch middel, en het is ook een noodzakelijk zout voor insuline en penicillinesynthese.
Risico's
Volgende en uiteindelijk worden enkele negatieve risico's of gevolgen veroorzaakt door het ammoniumacetaat vermeld:
- Het kan lichte irritaties op de huid veroorzaken, maar zonder erin te absorberen.
- Bij ingenomen veroorzaken maag, diarree, diurese, angst, grotere behoefte om te urineren, tremoren en andere symptomen die verband houden met ammoniakvergiftiging, evenals de lever beschadigd.
- Zijn inademing irriteert de neus, keel en longen.
Van de rest is het onbekend of kanker kan genereren, en elk mogelijk risico op brand door dit zout wordt weggegooid (althans onder normale opslagomstandigheden).
Referenties
- Inger Nahringbauer. (1967). Studies voor waterstofbinding. XIV. De kristalstructuur van ammoniumacetaat. Institute of Chemistry, University of Uppsala, Uppsala, Zweden. Cryst Act. 23, 956.
- Nationaal centrum voor biotechnologie -informatie. (2019). Ammoniumacetaat. PubChem -database. CID = 517165. Hersteld van: pubchem.NCBI.NLM.NIH.Gov
- Sullivan Randy. (2012). Geleidbaarheid van ammoniumacetaat. Hersteld van: chemdemos.Uoregon.Edu
- Viachem, Ltd. (S.F.)). Ammoniumacetaat. Hersteld van: Viacheminc.com
- Wikipedia. (2019). Ammoniumacetaat. Opgehaald uit: in.Wikipedia.borg
- New Jersey Department of Health. (2012). Ammoniumacetaat: informatieblad over gevaarlijke stoffen. [PDF]. Hersteld van: nj.Gov
- Xueyanghu. (S.F.)). Gebruik en risico's van ammoniumacetaat. Hersteld van: xueyanghu.WordPress.com
- « Alizarine -kenmerken, voorbereiding, gebruik en toxiciteit
- IJzerhydroxide (III) structuur, eigenschappen en gebruik »

