Molair absorberend
- 1861
- 33
- Kurt Aufderhar Jr.
Wat is molaire absorbingheid?
De Molair absorberend Het is een chemische eigenschap die aangeeft hoeveel licht een soort in oplossing kan absorberen. Dat wil zeggen, het is een eenheid die het vermogen van een oplossing meet om licht te absorberen.
Omdat het licht bestaat uit fotonen met energie (of golflengten), afhankelijk van de soort of gemengd mengsel, kan een foton in grotere mate worden opgenomen dan een andere. Betekent dat het licht wordt geabsorbeerd bij bepaalde golflengten die kenmerkend zijn voor de stof.
Aldus is de waarde van molaire absorptiteit recht evenredig met de mate van absorptie van licht tot een bepaalde golflengte. Als de soort weinig rood licht absorbeert, zal de absorberende waarde laag zijn. Als er een uitgesproken absorptie van het rode licht is, zal de absorptiteit een hoge waarde hebben.
Een soort die rood licht absorbeert, weerspiegelt een groene kleur. Als de groene kleur erg intens en donker is, betekent dit dat er een sterke absorptie van rood licht is.
Sommige groene tinten kunnen echter te wijten zijn aan de reflexen van verschillende reeksen geel en blauw, die worden gemengd en worden gezien als turquoise groen, smaragd, glas, enz.
Molaire absorberende vergelijking
Molaire absorptie is een constante gedefinieerd in de wiskundige uitdrukking van de wet van Lambert-Beer en wijst er gewoon op hoeveel licht de chemische soorten of mengsel absorbeert. De vergelijking is:
A = εbc
Waarbij a de absorptie van de oplossing is voor een geselecteerde λ -golflengte, is B de lengte van de cel waar het te analyseren monster is opgenomen, en daarom is het de afstand die het licht binnen de oplossing passeert, C is de Concentratie van de absorberende soorten, en ε, molair absorberend.
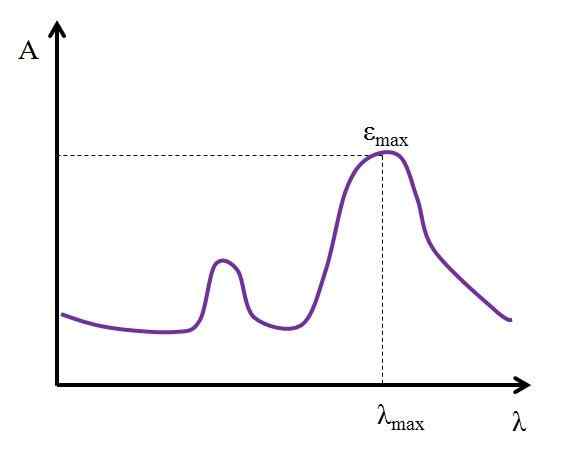
Het kan u van dienst zijn: AlquinosGegeven λ, uitgedrukt in nanometers, blijft de waarde van ε constant. Maar door de waarden van λ te veranderen, wil zeggen, door absorbisies te meten met lichten van andere energieën, ε veranderingen, het bereiken van een minimale of maximale waarde.
Als de maximale waarde bekend is, εMaximaal, Het wordt tegelijkertijd bepaald λMaximaal. Dat wil zeggen, het licht dat de soort het meest absorbeert:
 Grafiek waar de maximale lichtabsorptiewaarden van een chemische soort worden getoond. Bron: Gabriel Bolívar
Grafiek waar de maximale lichtabsorptiewaarden van een chemische soort worden getoond. Bron: Gabriel Bolívar Eenheden
Om de eenheden van ε te kennen, moeten we weten dat absorpties dimensieloze waarden zijn, en daarom moet de vermenigvuldiging van de B- en C -eenheden worden geannuleerd.
De concentratie van de absorberende soorten kan worden uitgedrukt in g/l of mol/l, en b komt meestal tot expressie in cm of m (omdat het de lengte van de cel is die de lichtstraal kruist). Molariteit is gelijk aan mol/l, dus C wordt ook uitgedrukt als m.
Aldus wordt het vermenigvuldigen van de B- en C -eenheden verkregen: M ∙ cm. De eenheden die ε moeten moeten hebben om de waarde van een te verlaten, zijn die die zich vermenigvuldigen.
U opruimen, u wordt gewoon verkregen m-1∙ cm-1, die ook kan worden geschreven als: l ∙ mol-1∙ cm-1.
Gebruik in feite M eenheden-1∙ cm-1 of L ∙ mol-1∙ cm-1 versnelt de berekeningen om de molaire absorptiteit te bepalen. Het wordt echter meestal ook uitgedrukt met M -eenheden2/mol of cm2/mol.
Wanneer ze met deze eenheden worden uitgedrukt, moeten sommige conversiefactoren worden gebruikt om de B- en C -eenheden te wijzigen.
Hoe u molaire absorptiteit kunt berekenen?
Directe goedkeuring
Molaire absorptie kan rechtstreeks worden berekend door de clearing in de vorige vergelijking:
Kan u van dienst zijn: zuren en basen in het dagelijks leven: reacties, gebruik, voorbeeldenε = a/bc
Als de concentratie van de absorberende soort bekend is, kan de lengte van de cel en wat de absorptie is die bij een golflengte is verkregen, worden berekend ε. Deze manier om te berekenen levert echter een ontoegankelijke en onbetrouwbare waarde op.
Grafische methode
Als de vergelijking van de wet van Lambert-Beer zorgvuldig wordt waargenomen, zal worden opgemerkt dat deze lijkt op de vergelijking van een lijn (y = ax+b).
Dit betekent dat als de A -as -waarden grafisch zijn. Het zou dus y zijn, x zou C zijn, en het zou gelijkwaardig zijn aan εb.
Daarom neemt de lijngrafiek gewoon twee punten om de helling te bepalen, dat wil zeggen. Zodra dit is gedaan, en de lengte van de cel, B, is het gemakkelijk om de waarde van ε te wissen.
In tegenstelling tot directe klaring, Graph Vs. Met C kunt u gemiddelde absorptiemetingen en de experimentele fouten verminderen, en ook door een enkel punt kunnen ze oneindig recht doorgeven, dus directe klaring is niet praktisch.
Ook kunnen experimentele fouten een lijn laten gaan door twee, drie of meer punten, dus de lijn verkregen na het toepassen van de minimale vierkante methode wordt daadwerkelijk gebruikt (functie die al is opgenomen in de rekenmachines).
Dit alles aanneemt een hoge lineariteit, en daarom naleving van de wet van Lamber-Beer.
Opgeloste oefeningen
Oefening 1
Het is bekend dat een oplossing van een organische verbinding met een concentratie van 0.008739 M presenteerde een absorptie van 0.6346, gemeten bij λ = 500 nm en met een cel van 0.5 cm lang. Bereken wat de molaire absorptie van het complex is tot genoemde golflengte.
Kan u van dienst zijn: Nikkel: Geschiedenis, eigenschappen, structuur, gebruik, risico'sUit deze gegevens kan het direct worden gewist ε:
ε = 0.6346/(0.5 cm) (0.008739 m)
145.23 m-1∙ cm-1
Oefening 2
De volgende absorpties gemeten bij verschillende concentraties van een metallisch complex bij een golflengte van 460 nm, en met een cel van 1 cm lange cel: lengte:
A: 0.03010 0.1033 0.1584 0.3961 0.8093
C: 1.8 ∙ 10-5 6 ∙ 10-5 9.2 ∙ 10-5 2.3 ∙ 10-4 5.6 ∙ 10-4
Bereken de molaire absorptiteit van het complex.
Er zijn in totaal vijf punten. Om ε te berekenen, is het noodzakelijk om ze te verankeren door de waarden van een op de y -as te plaatsen. Zodra dit is gedaan, wordt de lijn van de minimale vierkanten bepaald, en met de vergelijking kan deze worden bepaald ε.
In dit geval zijn de puntengrafieken en getrokken de lijn met een bepalingscoëfficiënt R2 van 0.9905, de helling is gelijk aan 7 ∙ 10-4, dat wil zeggen, εb = 7 ∙ 10-4.
Daarom zal met b = 1 cm ε 1428,57 m zijn-1.cm-1 (1/7 ∙ 10-4)).
Referenties
- Molaire verzwakkingscoëfficiënt. Opgehaald van.Wikipedia.borg
- Wetenschapstructuur. Molaire absorptie. Hersteld van sciencestruck.com
- Colorimetrische analyse (de wet van het bier of spectrofotometrische analyse). Chem hersteld.UCLA.Edu

